3. Rastreamento na atenção primária à saúde referente às principais doenças crônicas não transmissíveis no Brasil
No Brasil, as doenças crônicas não transmissíveis, como câncer, diabetes e hipertensão, têm um grande peso na saúde pública, e existem mecanismos no setor de APS para fazer o rastreamento de algumas das doenças de maior relevância epidemiológica. Existem estratégias de rastreamento e prevenção de alguns tipos de câncer, hipertensão e diabetes, mas ainda é necessário melhorar a profundidade e a abrangência de tais estratégias, especialmente expandir programas dirigidos à população para detectar câncer de mama e de colo do útero, com uma abordagem personalizada e mais estratégias de comunicação. Em relação a diabetes e hipertensão, o Brasil precisará desenvolver ainda mais os itinerários terapêuticos destas doenças com uma perspectiva centrada nas pessoas, integrando todos os prestadores de atenção à saúde em diferentes setores. As equipes de saúde da família precisarão ter as ferramentas, capacidades e incentivos adequados para assumir essas responsabilidades. Por fim, mas não menos importante, é a necessidade de sistema de informações mais abrangente, baseado em registros e que permita vincular diferentes fontes de dados.
No Brasil, assim como em outros países da OCDE, as doenças crônicas não transmissíveis, como câncer e doenças cardiovasculares, são de grande importância para a saúde pública. As doenças do aparelho circulatório foram a principal causa de morte no Brasil e nos países da OCDE em 2019, representando 27% e 31% de todas as mortes, respectivamente, seguidas pelo câncer, representando 17% e 25% de todas as mortes. O diabetes no Brasil é a quinta maior causa de mortalidade, com 5% de todas as mortes, superior aos 3% nos países da OCDE (Imagem 3.1). Isso reflete a transição epidemiológica das doenças transmissíveis para as não transmissíveis, onde o envelhecimento da população explica em grande parte esse padrão de mortalidade, mas a prevalência de diferentes fatores de risco e o desempenho do sistema de saúde também desempenham um papel relevante.
Nesse cenário, o Brasil, com base em seu forte sistema de APS, já construiu mecanismos de rastreamento de algumas das doenças de maior relevância epidemiológica. Alguns tipos de câncer, hipertensão e diabetes estão nessa lista, para os quais as estratégias de rastreamento e prevenção têm se mostrado eficazes e com boa relação custo-benefício, tornando-se uma ótima intervenção de saúde pública. No entanto, muitos desafios permanecem, como, por exemplo, com relação ao aumento da cobertura e expansão para novas doenças.
Este capítulo começa estabelecendo a atual taxa de câncer no Brasil, enquanto explora os pontos fortes e fracos do sistema de rastreamento do câncer no país. Em seguida, analisa o impacto da hipertensão e do diabetes na saúde da população e no sistema de saúde do Brasil e aborda o rastreamento da hipertensão e diabetes tipo 2 na APS como intervenções importantes para controlar essas condições médicas. Ao longo do capítulo, é fornecida uma série de recomendações sobre as prioridades da política para o Brasil no que diz respeito ao aumento da cobertura de rastreamento e a promoção da detecção precoce dessas condições.
O câncer é a segunda maior causa de morte nos países da OCDE, mas sua taxa está aumentando mais rapidamente em relação à primeira causa de morte, as doenças do aparelho circulatório. A taxa de mortalidade por doenças cardiovasculares diminuiu substancialmente nas últimas décadas, enquanto a mortalidade por câncer também diminuiu, mas em ritmo mais lento (OCDE, 2019[2]). Esta seção resume as taxas de incidência e mortalidade por câncer e suas mudanças ao longo do tempo no Brasil em comparação com os países da OCDE para ilustrar a importância das políticas de saúde pública no Brasil.
3.2.1. O Brasil tem incidência de câncer menor do que os demais países da OCDE, mas a mortalidade se manteve estável quando a taxa diminuiu na grande maioria dos países da OCDE
As taxas de incidência de câncer variam entre os países da OCDE, de mais de 400 novos casos por 100.000 pessoas na Austrália e Nova Zelândia, a menos de 200 casos no México, Chile, Colômbia e Costa Rica. O Brasil registra 215 novos casos por 100.000 habitantes, abaixo da média da OCDE de 294 (Imagem 3.2). É importante notar que as variações entre os países nas taxas de incidência refletem as diferenças não apenas nos novos cânceres que ocorrem a cada ano, mas também nas disparidades entre as políticas nacionais de rastreamento e na qualidade da vigilância e notificação do câncer.
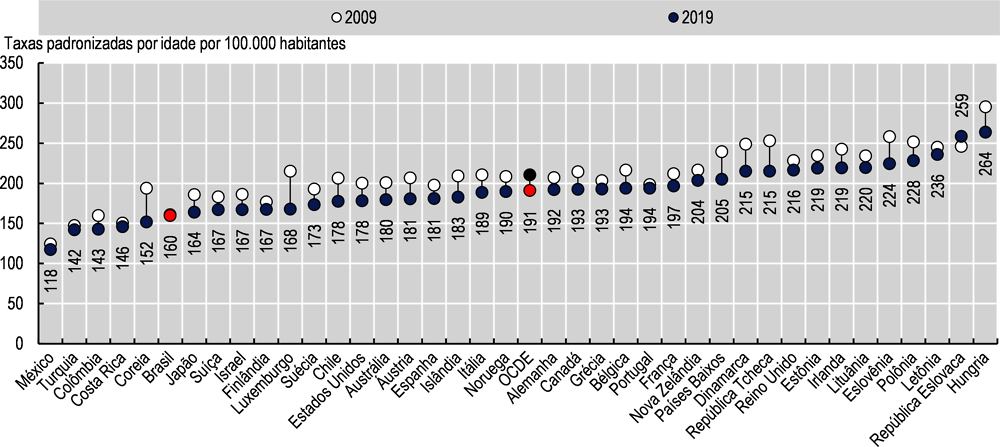
Apesar de ter taxa relativamente baixa de incidência de câncer, a mortalidade por câncer no Brasil não foi reduzida nos últimos anos. Entre 2009 e 2019, a mortalidade por câncer no Brasil passou de 161 para 162 mortes por 100.000 pessoas, enquanto a média da OCDE reduziu de 211 para 196. Essa redução foi observada na maioria dos países da OCDE, exceto no Chile e na Turquia (Imagem 3.3). A diminuição da mortalidade por câncer está relacionada ao diagnóstico precoce, o que traz forte argumento a favor da construção de esquemas de rastreio eficazes.
No Brasil, entre as mulheres, o câncer de mama é a maior causa de morte, com 20,6 mortes por 100.000 mulheres, representando 16,4% de todas as mortes por câncer de mulheres. As demais maiores causas são o câncer de traqueia, brônquio e pulmão, com 15,7 (11,5%); câncer colorretal e de ânus, com 13,1 (9,4%); e câncer do colo do útero, com 7,4 (6%). Nos países da OCDE, o câncer de traqueia, brônquios e pulmão ocupa o primeiro lugar entre as mulheres e a diferença mais relevante em relação ao Brasil está no câncer do colo do útero, que responde por apenas 2% das mortes por câncer de mulheres. Entre os homens, o câncer de traqueia, brônquios e pulmão explica o maior número de óbitos tanto no Brasil quanto nos países da OCDE, mas a proporção é maior nos outros países, com 24,1% em face de 13,8% no Brasil. Os cânceres de próstata, colorretal e ânus são a segunda e terceira causas de morte por câncer entre os homens no país, enquanto na média da OCDE, o câncer colorretal e de ânus ocupa o segundo lugar (Imagem 3.4).
Como nos países da OCDE, as taxas de mortalidade padronizadas por idade no Brasil devido a todos os tipos de câncer são mais altas entre os homens do que entre as mulheres: 202,8 mortes de homens por 100.000 homens em face de 135,8 mortes de mulheres por 100.000 mulheres. A diferença de gênero na mortalidade por câncer pode ser explicada, pelo menos em parte, pela maior prevalência de alguns fatores de risco entre os homens.
3.2.2. O câncer de mama e de colo do útero têm programas de rastreamento oportunístico de longo prazo, oferecidos principalmente por meio da APS
O controle do câncer de mama e colo do útero no Brasil tem décadas de desenvolvimento, tendo o Instituto Nacional de Câncer (INCA) e o Ministério da Saúde como os principais agentes em termos de planejamento nacional, enquanto a APS nos municípios é responsável pela prestação de cuidado. É importante ressaltar que o rastreio do câncer no Brasil é oportunístico, o que significa que não acontece no âmbito de um programa de base populacional elaborado e administrado em nível central para atingir a maioria da população em risco, mas sim como resultado de uma recomendação feita por um prestador de atenção à saúde durante uma consulta médica de rotina ou por autocuidado das pessoas. Um resumo dos principais desenvolvimentos históricos do rastreamento do câncer de mama e colo do útero é apresentado no Quadro 3.1.
As primeiras ações para o controle do câncer de mama e de colo do útero começaram em 1984, quando o Programa de Assistência Integral à Saúde da Mulher, que propunha atendimento além da atenção tradicional ao ciclo gravídico-puerperal, incluíram ações para a prevenção desses dois tipos de câncer. Em 1986, o Programa de Oncologia foi criado e, em 1991, ele foi finalmente sediado no INCA. Na década de 1990 e no início dos anos 2000, foram desenvolvidos diferentes projetos e programas pilotos, principalmente para o câncer do colo do útero.
Em 2005, o Ministério da Saúde lançou a primeira Política Nacional de Atenção Oncológica, com ênfase no câncer cervical e de mama. O controle desses cânceres passou a ser prioridade na agenda de saúde do país e faz parte do Plano de Ações Estratégicas para o Enfrentamento das Doenças Crônicas Não Transmissíveis no Brasil, 2011-22.
Em maio de 2013, ocorreu a última atualização da política nacional de atenção ao câncer, instituindo a Política Nacional para a Prevenção e Controle do Câncer, PNPCC, na Rede de Atenção à Saúde das Pessoas com Doenças Crônicas no âmbito do SUS. Nesse mesmo ano, foi criado o Sistema de Informação de Controle do Câncer (SISCAN), versão em plataforma web que integra os Sistemas de Informação do Controle de Câncer do Colo do Útero (SISCOLO) e do Câncer de Mama (SISMAMA).
Mais recentemente, em 2015, foram publicadas as diretrizes para a detecção precoce do câncer de mama e, em 2016, as diretrizes nacionais para o rastreio do câncer do colo do útero e manual para a gestão da qualidade dos laboratórios de citopatologia.
Fonte: INCA (2020[4]).
Na APS do Brasil, o rastreamento de câncer do colo do útero é realizado por meio do exame citopatológico (Papanicolau), que é oferecido a mulheres de 25 a 64 anos e que já tiveram atividade sexual. A rotina recomendada para o rastreamento no Brasil é repetir o exame de Papanicolau a cada três anos, após dois exames normais consecutivos realizados com intervalo de um ano. A repetição em um ano após o primeiro teste visa a reduzir a possibilidade de um resultado falso negativo na primeira rodada de rastreamento. A periodicidade de três anos é baseada na recomendação da OMS e nas diretrizes da maioria dos países com um programa de rastreamento organizado (INCA, 2016[5]). A Tabela 3.1 resume as características dos programas de câncer do colo do útero nos países da OCDE.
Quanto ao câncer de mama, o Ministério da Saúde do Brasil recomenda a mamografia a cada dois anos para mulheres de 50 a 69 anos como estratégia de rastreamento na APS. Além disso, o Ministério da Saúde não recomenda o ensino do autoexame como método de rastreamento e também o rastreio por ultrassom, termografia, tomossíntese e ressonância magnética. Para garantir o diagnóstico precoce do câncer de mama, o Ministério da Saúde recomenda que agentes do SUS desenvolvam estratégias de conscientização, sugiram encaminhamento urgente para serviços de diagnóstico de câncer de mama de pacientes com sintomas específicos e que todos os serviços sejam prestados no mesmo centro (Ministério da Saúde and INCA, 2017[6]). A Tabela 3.2 resume a idade alvo e as características dos programas de rastreamento do câncer de mama nos países da OCDE.
O financiamento desses programas de rastreamento é feito por meio do Ministério da Saúde, que destina recursos aos entes federados (estados e municípios), cabendo principalmente aos municípios a gestão e a prestação dos serviços. Em 2020, foi instituído um novo modelo de financiamento da APS (Programa Previne Brasil), combinando recursos financeiros de capitação ponderada, remuneração por desempenho e recursos para ações em contextos específicos (ver capítulo 4 do relatório). No âmbito do componente de pagamento por desempenho (15% do financiamento total), um dos sete indicadores de meta iniciais recompensa as equipes que realizam o rastreio do câncer do colo do útero.
No que se refere ao sistema de informação de controle do câncer, o PAINEL-Oncologia é um instrumento desenvolvido para fiscalizar a Lei nº 12.732, de 22 de novembro de 2012, a qual estabelece tempo máximo de espera de 60 dias para o início do tratamento de pacientes com neoplasia maligna comprovada. As informações do PAINEL-oncologia se referem ao momento de início do primeiro tratamento oncológico calculado a partir das informações das datas de diagnóstico e tratamento registradas. Também apresenta os casos diagnosticados por meio de exames anatomopatológicos. As informações sobre o diagnóstico do câncer de colo de útero e mama estão disponíveis desde 2013, desde a implantação do Sistema de Informação de Controle do Câncer (SISCAN). Para os outros cânceres, informações diagnósticas decorrentes de biópsia ou exames anatomopatológicos (exceto para câncer de colo do útero e mama) estão disponíveis a partir de maio de 2018, mas, a partir de outras fontes, foi possível calcular o momento de início do primeiro tratamento a partir de 2013 também. Os dados apresentados no PAINEL-oncologia se referem exclusivamente aos usuários que possuem carteira nacional de saúde (DATASUS, 2021[7]). Além disso, uma rede de 17 Registros de Câncer com Base na População, 16 localizados em capitais e um deles em uma cidade não capital, fornece informações cruciais sobre incidência, tendências e sobrevivência (INCA, 2013[8]).
3.2.3. O rastreio do câncer de mama e câncer do colo do útero precisa aumentar drasticamente a cobertura entre as populações-alvo
O rastreio do câncer de mama no Brasil melhorou nos últimos anos. Entre 2014 e 2019, passou de 15,2% para 24,2% no grupo-alvo de mulheres de 50 a 69 anos de idade. No entanto, a cobertura do rastreamento do câncer de mama no Brasil é muito baixa quando comparada aos países da OCDE, ficando abaixo de todos os países da OCDE e bem abaixo dos 58% de cobertura média (Imagem 3.5).
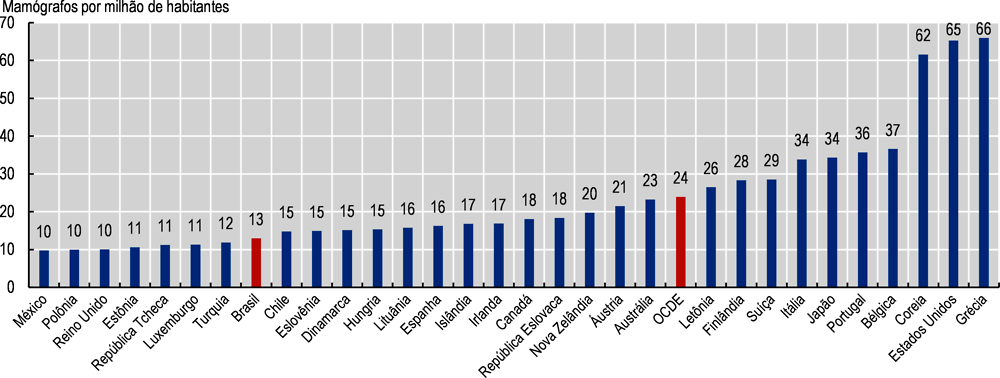
Um dos principais capacitadores para conduzir o rastreamento do câncer de mama é a disponibilidade de mamógrafos. Em 2020, o Brasil tinha 13 mamógrafos por milhão de pessoas, quase metade do que a média da OCDE de 24 e perto da menor disponibilidade de 10 no México, Polônia e Reino Unido (Imagem 3.6). Essa constatação mostra que o Brasil tem espaço para investir mais em tecnologias médicas com o objetivo de melhorar o acesso justo da população. Ao mesmo tempo, essa expansão do acesso pode ser acompanhada pelo desenvolvimento de estruturas regulatórias nas áreas de registro, avaliação e regras de compra. A existência de diretrizes clínicas atualizadas para o rastreamento do câncer de mama no Brasil é um passo à frente na necessária tarefa de promover o uso racional de tecnologias diagnósticas com o objetivo de reduzir o uso de exames diagnósticos desnecessários, além de subsequentes procedimentos e tratamentos.
Uma revisão sistemática incluindo 30 estudos identificou os principais fatores do sistema de saúde que levaram ao diagnóstico tardio do câncer de mama no Brasil (Da Costa Vieira, Formenton and Bertolini, 2017[9]). Os resultados evidenciaram problemas relacionados à distribuição dos mamógrafos, com maior proporção de mamógrafos não utilizados no Norte/Nordeste do Brasil, e que a maioria das mamografias ocorreu no setor privado. Outro estudo que analisou a Pesquisa Nacional de Saúde de 2013 constatou que 59,4% das mulheres usuárias do SUS e 83,9% das mulheres com plano de saúde particular declararam ter pedido médico de mamografia. As pessoas que possuem plano de saúde particular, nível de educação superior e que são de raça branca têm maior probabilidade de ter essa solicitação médica (Silva et al., 2017[10]). Essas constatações mostram alguns dos problemas de organização do sistema de saúde e das desigualdades sociais encontrados no Brasil.
O rastreamento do câncer do colo do útero no Brasil melhorou substancialmente de 20,5% em 2014 para 37% em 2019. No entanto, ainda permanece bem abaixo da cobertura média da OCDE de 57% e abaixo de todos os países da OCDE, exceto Costa Rica e Hungria (Imagem 3.7).
Vários problemas relacionados ao rastreamento do câncer do colo do útero foram documentados no Brasil. Um estudo que realizou uma análise de tendência dos indicadores de qualidade do programa de rastreamento do câncer do colo do útero em todas as regiões e estados brasileiros de 2006 a 2013 constatou que a parcela estimada da população-alvo que realizou o Papanicolau era inferior à recomendada por diretrizes internacionais nas regiões Norte, Nordeste e Centro-Oeste. As tendências desse indicador permaneceram estáticas ao longo dos anos em todas as regiões do Brasil. Os autores concluíram que “o programa de rastreamento do câncer do colo do útero ainda está longe de ser eficiente” (Costa et al., 2018[11]). Outro estudo usando dados de 2008 constatou que as áreas rurais eram mais propensas a terem pessoas que nunca fizeram o rastreio de Papanicolau, enquanto as regiões Norte e Nordeste apresentaram a maior prevalência de mulheres que nunca se submeteram ao exame. As mulheres mais carentes, com menor escolaridade, de cor da pele não branca e as mais jovens também foram menos examinadas, mostrando os padrões de desigualdades sociais (Martínez-Mesa et al., 2013[12]).
3.2.4. A sociedade brasileira é bastante ativa e as principais partes interessadas estão regularmente envolvidas na tomada de decisões sobre questões de controle do câncer
O Brasil tem bons exemplos de envolvimento de partes interessadas nas políticas de câncer. As vozes das partes interessadas locais e regionais, como administrações municipais e estaduais e prestadores de serviços de atenção à saúde, estão representadas em espaços institucionais como o Conselho Nacional de Saúde, CONASS e CONASEMS. Além disso, representantes da sociedade civil e usuários do SUS aplicam o chamado controle social democrático ao participarem da Conferência Nacional de Saúde, dos Conselhos de Direitos e dos Conselhos de Saúde. Os dois últimos têm participação expressiva nas esferas federal, estadual e municipal (Ministério da Saúde, 2013[13]). Entre os temas incluídos, o câncer faz parte da pauta regularmente.
O INCA desenvolve diversas iniciativas para engajar a sociedade civil. A instituição possui um Conselho Consultivo (CONSINCA) com representantes de entidades técnico-científicas relacionadas à prevenção e controle do câncer; prestadores de serviços do SUS; conselhos de gestão do SUS; e usuários do SUS. Nos últimos anos, o INCA organizou conferências em diferentes partes do país com movimentos de mulheres com o objetivo de introduzir o tema do controle do câncer em seus planos de trabalho. Além disso, o INCA tem convocado encontros com jornalistas com o objetivo de discutir as melhores formas de comunicar informações relacionadas ao controle do câncer, inclusive encontros especiais com dirigentes de rádios do Norte do Brasil, uma vez que, nessa região, as rádios têm grande audiência da população.
O Todos Juntos Contra o Câncer (TJCC, 2021[14]) é um movimento da sociedade civil que reúne representantes de diversos setores, como gestores de saúde, entidades médicas, hospitais, associações profissionais, pesquisadores, profissionais da mídia, organizações de pacientes e outros, comprometidos em garantir o direito do paciente ao acesso universal e igualitário ao serviço de atenção à saúde. O TJCC desenvolve diversas iniciativas para garantir a implementação da Política Nacional de Prevenção e Controle do Câncer, incluindo as áreas relacionadas à prevenção e rastreamento.
No setor privado, o “Sistema S” realiza ações que visam a apoiar a promoção, prevenção e tratamento do câncer. O “Sistema S” se refere a nove instituições administradas de forma independente por federações e confederações empresariais dos principais setores da economia. Embora prestem serviços de interesse público (por exemplo, educação, serviços sociais, transporte etc.), essas entidades não estão vinculadas a nenhuma esfera de governo, prestando tais serviços em um espaço de atuação diferente.
3.2.5. Apesar das iniciativas de prevenção, os desfechos do câncer do colo do útero e de mama permanecem pouco favoráveis, com aumento da mortalidade e redução da sobrevivência nos últimos anos
Entre 2008 e 2019, a mortalidade por câncer de mama aumentou de 19,2 para 20,8 mortes por 100.000 mulheres no Brasil (+8,3%), o que é o oposto do que aconteceu em média entre os países da OCDE: uma diminuição de 26,4 para 23,7 (-10%). Apenas oito dos 37 países da OCDE enfrentaram aumento na mortalidade por câncer de mama, com a Turquia, Colômbia e Coreia tendo aumento de 15% ou mais no período (ver Imagem 3.8). Apesar da mortalidade por câncer de mama no Brasil ser inferior à média da OCDE, a tendência de aumento é preocupante.
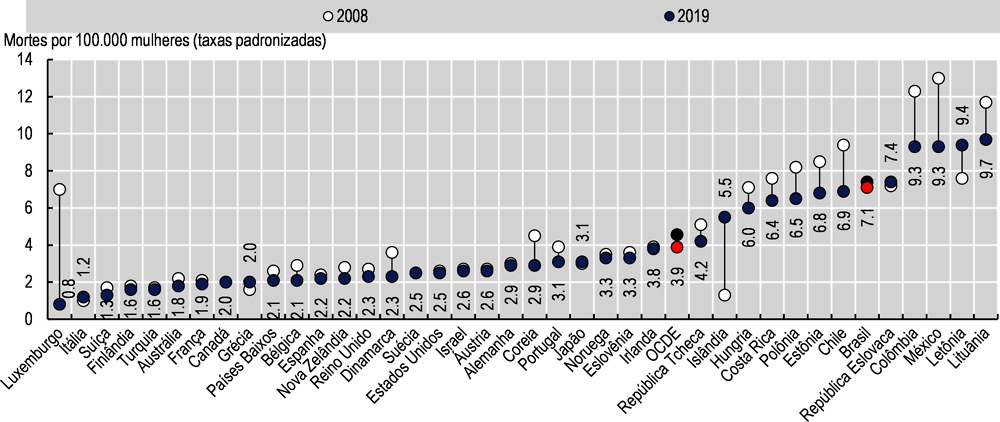
O quadro da mortalidade por câncer do colo do útero no Brasil parece mais problemático. Entre 2008 e 2019, a mortalidade permaneceu estável em torno de 7,1 e 7,4 mortes por 100.000 mulheres, em comparação com uma diminuição nos países da OCDE de 4,6 para 3,9 (-14,7%). Apenas sete dos 37 países da OCDE enfrentaram um aumento, com a Islândia, Grécia, Itália e Letônia com aumento de 15% ou mais (ver Imagem 3.9). Nesse caso, a mortalidade por câncer do colo do útero no Brasil é substancialmente maior do que a média da OCDE.
Essas tendências preocupantes também são observadas em termos da sobrevida líquida de 5 anos dos pacientes de câncer. Em todos os locais relativos ao câncer selecionados, o Brasil tem taxas de sobrevida mais baixas em comparação com as médias da OCDE. Comparando os períodos de 2005-09 e 2010-14, a sobrevida do câncer de mama caiu em mais de 2 anos no Brasil, enquanto aumentou um ano nos países da OCDE. A sobrevida do câncer de cólon também diminuiu mais de 2 anos, enquanto na OCDE aumentou quase 2 anos. A sobrevida do câncer do colo do útero diminuiu 11,3% e a sobrevida do câncer de pulmão diminuiu 11% no Brasil entre 2000-04 e 2010-14, enquanto na OCDE aumentaram 1,5% e 24,8%, respectivamente (Tabela 3.3).
3.2.6. A vacinação contra o HPV está sendo muito positiva, mas pode melhorar
Em 2014, o Ministério da Saúde, por meio do Programa Nacional de Imunizações, deu início à campanha de vacinação de meninas entre 9 e 13 anos contra o Papilomavírus Humano (HPV). Em 2017, também foram incluídas meninas com 14 anos e meninos entre 11 e 14 anos. A vacina é quadrivalente, oferecendo proteção contra os subtipos 6, 11, 16 e 18 do HPV, prevenindo doenças como lesões pré-cancerosas, câncer do colo do útero, vulva e vagina, ânus e verrugas genitais. A vacina é oferecida pelo SUS nas Unidades Básicas de Saúde e nas campanhas de vacinação nas escolas. O Guia Prático do HPV - Perguntas e Respostas foi lançado pelo Programa Nacional de Imunizações, em colaboração com o INCA, buscando esclarecer as principais dúvidas sobre o assunto (INCA, 2020[15]).
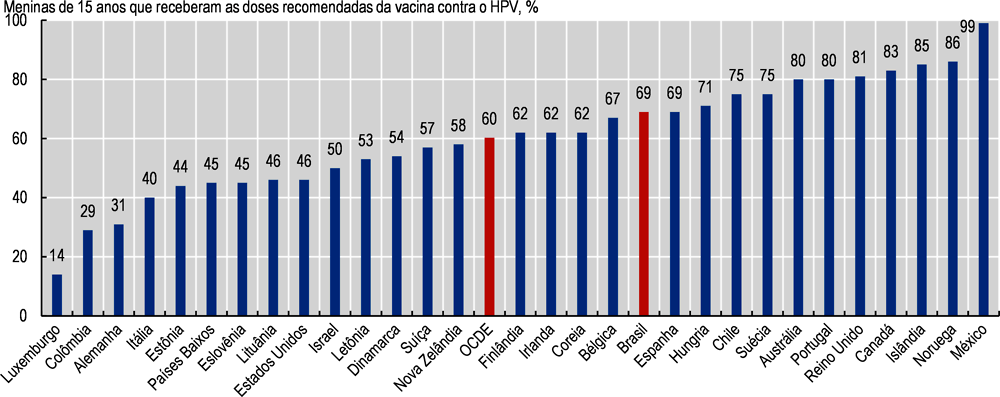
Em 2018, a cobertura da vacina contra o HPV no Brasil era de 69%, acima da média da OCDE de 60% (ver Imagem 3.10). No entanto, está abaixo da meta de cobertura de 80% que foi definida pelas autoridades brasileiras (INCA, 2020[15]).
Embora ainda não disponível para aplicação, a ANVISA já aprovou nova vacina contra o HPV, que protege contra nove tipos de vírus. É oferecida para meninas de 9 a 14 anos e meninos de 11 a 14 anos, e para pessoas portadoras de HIV - AIDS na faixa etária de 9 a 26 anos. O esquema de vacinação é de três doses (intervalo de 0, 2 e 6 meses). Outras faixas etárias podem ter vacinas disponíveis no setor privado, se indicado por seus médicos.
3.2.7. Uma estratégia nacional de prevenção e rastreamento do câncer na APS favoreceria sinergia de esforços para melhorar os desfechos do câncer no Brasil
O Brasil pode desenvolver uma estratégia nacional única para a prevenção e rastreamento do câncer na APS. Indícios científicos e participação social podem ser dois princípios orientadores fundamentais para avançarmos em direção a programas de rastreamento com base na população. Essa estratégia pode levar em consideração a renovação dos programas de rastreamento existentes do câncer do colo do útero e de mama; a expansão para novos locais de câncer, como cólon e pulmão; a introdução de cartas-convite e lembretes de rastreamento personalizados sistemáticos; o redesenho dos sistemas de informação de controle do câncer; e o uso de tecnologias de informação e comunicação para melhorar a consciência pública e a educação sobre saúde.
O Brasil pode avançar com programa de rastreio do câncer do colo do útero com base na população ao mesmo tempo que introduz o teste primário de HPV-DNA em ambientes de APS
Na área de rastreio do câncer do colo do útero, especialmente após a introdução da vacina contra o HPV, o Brasil poderia considerar a instituição de testes primários do DNA de tipos de HPV oncogênicos como novo método de rastreamento. Idealmente, isso exigiria uma mudança em direção a um programa de rastreamento com base na população, analisando ainda mais a epidemiologia atual no país e conduzindo avaliação completa de tecnologia em saúde para compreender os diferentes fatores que determinarão a eficácia e o custo-benefício da implementação de tal programa organizado. Seria importante usar testes de HPV confiáveis e validados em laboratórios qualificados, credenciados por órgãos de credenciamento autorizados (como a ANVISA) e em conformidade com os padrões internacionais. O treinamento dos profissionais de saúde seria outro componente crucial, junto com as estratégias de comunicação com as mulheres da população alvo.
Uma análise sistemática recente com foco em países de baixa e média renda descobriu que o rastreamento com base na citologia foi o método de rastreio menos eficaz e mais caro, enquanto o teste de HPV coletado teve o melhor custo-benefício ao gerar ganhos de cobertura populacional em relação a outros métodos de rastreamento. O custo do teste de HPV e a perda do acompanhamento também foram fatores importantes (Mezei et al., 2017[17]). As diretrizes europeias recomendam o uso de teste primário de HPV dentro de programa organizado de base populacional para o rastreamento do câncer do colo do útero, evitando um segundo teste (teste primário de HPV e citologia) em qualquer idade (von Karsa et al., 2015[18]). As diretrizes da American Cancer Society de 2020 também recomendam o teste primário de HPV como o método de rastreamento preferencial (Fontham et al., 2020[19]).
Essa estratégia nacional deve incluir garantia de qualidade no monitoramento da realização do rastreio do câncer do colo do útero. As diretrizes europeias definem essa realização através da obtenção de: (1) uma cobertura de pelo menos 95% das mulheres alvo; (2) uma cobertura de exame de pelo menos 70% (85% seria desejável); e (3) taxa de participação de pelo menos 70% (85% seria desejável) (von Karsa et al., 2015[18]). O Quadro 3.2 resume a experiência da Finlândia e da Itália com a implementação de testes de HPV.
A auto-amostragem do teste de HPV está sendo explorada como nova estratégia para aumentar a cobertura do rastreamento e pode ser considerada no Brasil, por exemplo, em estudos-piloto. Uma análise sistemática incluindo 34 estudos, a maioria proveniente de países de alta renda, encontrou maior aceitação de rastreamento entre os participantes da auto-amostragem de HPV em comparação com o tratamento padrão (por exemplo, Papanicolau, inspeção visual com ácido acético, teste de HPV coletado por médicos) (RR: 2,13, IC de 95% 1,89 a 2,40). A aceitação foi maior quando os kits de auto-amostragem de HPV foram enviados diretamente para as casas das mulheres (RR: 2,27, IC de 95% 1,89 a 2,71) ou oferecidos de porta em porta por um profissional de saúde (RR: 2,37, IC de 95% 1,12 a 5,03). No entanto, a meta-análise não mostrou nenhuma diferença estatisticamente significativa na vinculação à avaliação clínica/tratamento entre os estudos (RR: 1,12, IC de 95% 0,80 a 1,57) (Yeh et al., 2019[20]). As diretrizes europeias afirmam que a precisão clínica do teste primário de HPV em amostras auto-coletadas é suficiente para conduzir programas piloto (von Karsa et al., 2015[18]), enquanto a American Cancer Society não incluiu uma recomendação quanto a isso porque a Food and Drug Administration ainda não aprovou a auto-amostragem (Fontham et al., 2020[19]).
Na Finlândia, mulheres de 30 a 60 anos são convidadas a participar do rastreamento de câncer do colo do útero a cada cinco anos. Alguns municípios também convidam mulheres com 25 e/ou 65 anos para o rastreamento. Cerca de 70% das convidadas participam desse rastreamento do câncer do colo do útero. O teste de rastreamento do colo do útero convencional usado na Finlândia é o teste de Papanicolau, enquanto o teste de HPV é aplicável ao rastreio do câncer do colo do útero em mulheres com mais de 35 anos de idade. Amostras para exame de HPV e Papanicolau são colhidas das participantes no rastreio de HPV. Após um teste de HPV positivo, a amostra de Papanicolau também é analisada, após a qual qualquer tratamento adicional necessário é decidido. O teste de rastreamento do HPV deve atender aos requisitos da IARC e da OMS (6.). Antes de serem implementados, a validade dos novos testes de HPV deve ser sempre verificada, comparando-os com os testes HC2 ou PCR GP5+/6+ mais estudados. O encaminhamento para colposcopia é feito para cerca de 1% das participantes. Além disso, cerca de 5% são convidadas para um teste de acompanhamento antes do próximo convite de rastreamento. Uma análise anual fornece uma visão geral abrangente do programa de rastreamento do câncer do colo do útero finlandês, apresentando informações sobre presença, resultados, séries temporais e custos do rastreamento. A história do rastreio do câncer do colo do útero na Finlândia e seu impacto na taxa de câncer também são discutidos.
Em 2013, com base em um relatório de avaliação de tecnologia de saúde, o Ministério da Saúde italiano incluiu o teste de HPV a cada 5 anos como uma opção para programas de rastreamento para mulheres com mais de 30 anos de idade. O teste exclusivo de HPV foi definido como teste primário, com citologia a ser usada apenas como teste de rastreamento em mulheres com HPV+. Mulheres com resultados negativos na análise de citologia são convidadas a repetir o teste de HPV após 12 meses e encaminhadas para colposcopia se ainda for positivo. O Plano Nacional de Prevenção 2014-2018 tem como objetivo a implementação total do rastreamento com base no HPV até 2018.
Fonte: Registro Finlandês de Câncer (2020[21]), Triagem de câncer cervical – Syöpärekisteri, https://cancerregistry.fi/screening/cervical-cancer-screening; (Ronco, 2020[22]), Elementos centrais do novo programa de rastreamento de câncer cervical baseado em HPV na Itália, https://www.hpvworld.com/articles/core-elements-of-the-new-hpv-based-cervical-cancer-screening-programme-in-italy.
O Brasil já tem experiências práticas com o uso do teste de HPV-DNA para rastreamento. Por exemplo, um estudo avaliou o rastreamento do HPV-DNA em São Paulo, incluindo 16.102 mulheres, descobrindo que a prevalência de alto risco do HPV-DNA foi de 14,9%, enquanto anormalidades citológicas foram encontradas em 7,2% das mulheres. O HPV DNA detectou número significativo de pacientes com lesões pré-malignas não detectadas pela citologia e todos os 16 casos positivos de neoplasia intraepitelial cervical foram casos de HPV-DNA+. Os autores concluíram que a genotipagem do HPV pode reduzir a taxa de encaminhamento colposcópico e que o teste de HPV-DNA se mostrou viável e vantajoso em relação ao rastreamento citológica atual no sistema de saúde pública (Levi et al., 2019[23]). Outro estudo realizado em três cidades brasileiras descobriu que as barreiras mais relevantes para um programa de rastreamento mais abrangente estão relacionadas ao excesso de transporte necessário para acessar as clínicas, horários de atendimento inconvenientes e falta de educação pública. Além disso, a citologia teve muitos resultados insatisfatórios e baixa positividade, o acompanhamento foi incompleto em todas as etapas e os laboratórios forneceram resultados de citologia e biópsia atrasados (mais de 3 meses). Por fim, as clínicas de rastreamento não providenciaram ou rastrearam encaminhamentos para colposcopia; as clínicas de colposcopia não receberam informações das clínicas de encaminhamento e os prontuários médicos eletrônicos ainda não substituíram os registros físicos, levando a erros e perda de prontuários (Ribeiro et al., 2018[24]). A identificação dessas e de outras barreiras seria muito importante para a elaboração de políticas e uma eventual fase de implementação.
O rastreio do câncer de mama pode evoluir para programa organizado de base populacional e mais ferramentas podem ser fornecidas na APS
Como na grande maioria dos países da OCDE (ver Tabela 3.2), o Brasil pode desenvolver um programa de rastreamento do câncer de mama de base populacional. Na prática, isso exigiria a estrutura eficaz de novas chamadas, registro de rastreamento e garantia de qualidade robusta em todos os níveis. O atual processo de registro da população na APS do Brasil vai no sentido de identificar individualmente a população-alvo elegível em cada área atendida (por exemplo, municípios), portanto, representa oportunidade para o desenvolvimento de programas de rastreamento organizados.
As diretrizes europeias sobre o rastreio e diagnóstico do câncer de mama descrevem sete características de um programa de rastreamento organizado (ECIBC, 2020[25]): 1. uma política que especifica a população-alvo; 2. método e intervalo de rastreio; 3. um convite ativo de toda a população-alvo; 4. uma equipe responsável pela supervisão dos centros de rastreio; 5. uma estrutura de decisão e responsabilidade pela gestão da atenção à saúde; 6. um sistema de garantia de qualidade que utiliza dados relevantes; e 7. monitoramento da ocorrência de câncer na população-alvo.
A capacitação das equipes de APS seria crucial. Conforme previsto nas diretrizes da OMS (WHO, 2017[26]), as capacidades de diagnóstico precoce requerem diretrizes ou protocolos e a sensibilização dos prestadores para os sinais e sintomas do câncer para melhorar a precisão do diagnóstico; tempo suficiente para avaliar os pacientes e treinar os profissionais em como diagnosticar o câncer, incluindo o uso de dispositivos médicos; promoção de uma comunicação clara entre o prestador e o paciente; e desenvolvimento de mecanismos de encaminhamento confiáveis. Além disso, a distribuição dos mamógrafos em todo o país também deve ser revisada para atingir abastecimento balanceado de acordo com a necessidade da população.
O Brasil poderia se organizar a partir de experiências locais que progrediram em direção a um programa organizado de rastreamento. Por exemplo, um programa do SUS de rastreamento de câncer de mama organizado na comunidade do Andaraí, no Rio de Janeiro, voltado para mulheres assintomáticas com idade entre 50-69 anos apresentou taxa de cobertura mamográfica de 70%, sugerindo que o rastreio de base populacional é viável (Gioia et al., 2018[27]).
Convites e lembretes personalizados sistemáticos de equipes de APS podem melhorar a cobertura de rastreamento do câncer
Como parte dos programas de rastreamento populacional organizados, o Brasil poderia adotar uma abordagem mais sistemática e personalizada para convidar as populações-alvo, como foi implementado em muitos países da OCDE. Número cada vez maior de países da OCDE envia carta-convite pessoal para o rastreamento do câncer a cada indivíduo do grupo-alvo, emitida por meio de registro de maneira sistemática. No Brasil, entretanto, não existe iniciativa nacional em relação a esses convites, que, na prática, só são implementados em alguns níveis locais, dependendo da iniciativa de determinados municípios ou equipes de APS.
Na maioria dos países da OCDE, a carta-convite inclui informações sobre os benefícios e danos potenciais do rastreamento do câncer, como resultados de rastreamento falso-positivos, diagnóstico e tratamento excessivo, e pede o consentimento informado assinado ou verbal para o rastreio (IARC, 2017[28]). Essa prática está de acordo com as recomendações internacionais, uma vez que a OMS recomenda programas organizados de rastreamento de mamografia de base populacional para fornecer informações sobre os benefícios e riscos do rastreamento de mamografia para que as mulheres-alvo possam tomar decisão informada antes de se submeterem ao referido exame (WHO, 2014[29]). Em muitos países da OCDE, esforços adicionais também são feitos para convidar pessoas com resultados de rastreamento positivos no passado para avaliação de acompanhamento e, em alguns países como Dinamarca, Finlândia, Alemanha, Irlanda, Itália, Países Baixos, Espanha, Suécia e Reino Unido, a data da consulta para realizar a mamografia é incluída na carta para facilitar ainda mais o acesso ao rastreamento do câncer (IARC, 2017[28]; ECIBC, 2020[30]).
Uma revisão sistemática identificou as intervenções mais eficazes para aumentar a participação em programas de rastreamento organizados. Intervenções como lembretes postais, lembretes por telefone, assinatura do médico da APS na carta-convite e consulta agendada em vez de aberta foram todas eficazes para aumentar a participação no rastreio do câncer de mama, colo do útero e cólon. O envio de kit para auto-amostragem de espécimes do colo do útero também aumentou a participação dos que não participavam (Camilloni et al., 2013[31]). Outra revisão sistemática constatou que as mensagens de texto (serviço de mensagens de texto, SMS) parecem aumentar moderadamente as taxas de rastreamento de câncer do colo do útero e de mama e podem ter pequeno efeito no rastreamento do câncer colorretal (Uy et al., 2017[32]). Estudos futuros também precisariam examinar o custo associado a cada uma das opções de convite e seu impacto, a fim de identificar as estratégias com custo-benefício mais adequado que podem ser diferentes entre as regiões do Brasil.
O rastreio na APS do Brasil poderia explorar a expansão para locais como câncer de cólon e pulmão
Como os cânceres colorretal e de pulmão estão entre os cânceres mais importantes do país (ver Imagem 3.4), o Brasil poderia explorar a possibilidade de criar programas nacionais de rastreio referentes a esses tipos de câncer.
Para o câncer colorretal, que representa a terceira maior causa de mortalidade por câncer no Brasil em homens e mulheres, o rastreamento oportunístico está disponível. A recomendação no SUS é priorizar ações de diagnóstico precoce e atendimento personalizado para os grupos de alto risco. Reconhecendo as diferentes realidades epidemiológicas e da rede de atenção à saúde no Brasil, mais estudos ainda são necessários para dar suporte à análise da viabilidade de introdução do rastreio nesses diferentes contextos (INCA, 2019[33]).
Como referência, número crescente de países da OCDE introduziu programa de rastreamento de câncer colorretal gratuito baseado na população para a população-alvo nos últimos anos e, em muitos desses países, a população-alvo é a população de 50 e 60 anos de idade, muitas vezes com idade superior limite entre 64 e 74 (OCDE, 2013[34]). As diretrizes europeias recomendam que “apenas programas de rastreamento organizados devem ser implementados, em oposição à detecção de casos ou rastreamento oportunístico, uma vez que apenas os programas organizados podem ter a qualidade devidamente garantida”. Também afirmam que várias questões devem ser consideradas: a estrutura jurídica, a disponibilidade e precisão de dados epidemiológicos e demográficos, a disponibilidade de serviços de garantia da qualidade para diagnóstico e tratamento, esforços de promoção, o grau de coordenação com o trabalho de registros de câncer e acompanhamento de causas de morte em nível individual (Malila, Senore and Armaroli, 2012[35]). Nos Estados Unidos, a força-tarefa da atenção preventiva (USPSTF, 2021[36]) recomenda que adultos com idade entre 50 e 75 anos sejam rastreados a respeito de câncer colorretal, seja com testes de fezes, sigmoidoscopia flexível, colonoscopia e colonografia por TC (colonoscopia virtual), variando dependendo da história do paciente e da disponibilidade do sistema de saúde (Bibbins-Domingo et al., 2016[37]).
Em relação ao câncer de pulmão, que representa a segunda causa de mortes por câncer no Brasil (ver Imagem 3.4), o rastreio da população em geral não é atualmente recomendada no país e qualquer exame deve ser discutido entre o paciente e o médico (INCA, 2020[38]). O rastreamento do câncer de pulmão não é comum nos países da OCDE, mas existe no Canadá, Japão e Estados Unidos. A Força-Tarefa Canadense em Atenção à Saúde Preventiva recomenda o rastreio do câncer de pulmão com três tomografias computadorizadas de baixa dose (LDCT) anuais consecutivas em indivíduos de alto risco, adultos com idades entre 55-74 anos que atualmente fumam ou pararam há menos de 15 anos, com história de tabagismo de pelo menos 30 anos-maço (CTFPHC, 2016[39]). No Japão, a radiografia torácica anual é recomendada para pessoas com 40 anos ou mais e a citologia do escarro também é recomendada para fumantes com 50 anos ou mais que fumaram mais de 600 cigarros ao longo da vida (OCDE, 2019[40]). Nos Estados Unidos, a USPSTF divulgou uma recomendação atualizada em março de 2021. O rastreamento do câncer de pulmão é recomendada como um rastreamento anual com LDCT em adultos com idade entre 50 e 80 anos que têm uma história de tabagismo de 20 anos-maço e atualmente fumam ou pararam de fumar nos últimos 15 anos. O rastreamento deve ser descontinuado assim que a pessoa concluir 15 anos sem fumar ou desenvolver problema de saúde que limite substancialmente a expectativa de vida ou a capacidade ou vontade de fazer uma cirurgia pulmonar curativa (USPSTF, 2021[36]).
O Brasil poderia desenvolver análise completa baseada em indícios, incluindo estudos de custo-benefício, para identificar os potenciais danos e benefícios da implementação do rastreamento do câncer colorretal e/ou de pulmão no país, juntamente com definições apropriadas em áreas como critérios de elegibilidade, intervalos de rastreamento, iniciativas locais existentes, esquemas de monitoramento e melhoria da qualidade, infraestrutura e equipamentos, assim como mecanismo de pagamento.
O redesenho dos sistemas de informação de controle do câncer pode ajudar a gerenciar os programas de rastreio de forma mais eficaz
O Brasil desenvolveu sistema de monitoramento para o rastreio do câncer (SISCAN), atenção ao câncer (PAINEL-Oncologia) e epidemiologia do câncer em nível populacional (Registro de câncer de base populacional), que fornece boa base de infraestrutura de informações. Além disso, pesquisas de base populacional (Vigitel) coletam regularmente a cobertura de rastreamento e as barreiras ao rastreamento com o objetivo de buscar maneiras de aumentar a cobertura de rastreamento.
Os principais desafios para a infraestrutura de informações sobre o câncer no Brasil, incluindo informações de rastreamento, estão relacionados à cobertura, interconexão e feedback. Os desafios de cobertura se referem ao alcance da extensão total da população-alvo de cada programa de rastreamento (incluindo ações no setor privado). Os desafios de interconexão estão relacionados aos vínculos entre os sistemas de informação existentes, onde a ampliação do cartão nacional de saúde seria fundamental. Os desafios de feedback se referem à provisão de informação aos diferentes agentes do sistema de saúde, principalmente para todas as equipes de APS, para que as decisões e ações possam ser informadas por meio de informações regulares e atualizadas.
Um sistema de informações abrangente baseado em registros e capaz de acompanhar cada paciente individualmente é essencial para o gerenciamento eficiente dos programas de rastreamento e atendimento oncológico. Pode identificar a população-alvo que participou ou não participou dos programas de rastreamento, aqueles que são monitorados fora do programa devido ao diagnóstico prévio de câncer e/ou predisposição genética para câncer específico e aqueles que não consentem em fazer o rastreio. Com esse sistema, convites e lembretes personalizados para o rastreio do câncer, importantes para aumentar a cobertura do rastreio, podem ser enviados sistematicamente à população-alvo.
Os sistemas de informação integrados geram dados que precisam ser analisados periodicamente para avaliar a eficácia dos protocolos de rastreamento de câncer existentes, como grupo-alvo, frequência e/ou métodos de rastreamento e em populações com antecedentes diferentes. O Brasil já começou a produzir esses dados, que também estão publicamente disponíveis online por meio do DATASUS. Vários países da OCDE usam informações sobre o rastreamento do câncer para também melhorar a qualidade dos programas de rastreamento. Fornecem feedback para prestadores individuais e o benchmarking também é possível. Uma revisão sistemática do material dá suporte a esses esforços adicionais, pois descobriu que a avaliação e o feedback do prestador contribuem para a maior cobertura de rastreio do câncer do colo do útero, de mama e colorretal (Sabatino et al., 2012[41]).
Melhores tecnologias de informação e comunicação podem melhorar a conscientização pública e a educação sobre saúde
Junto com convites mais personalizados para o rastreamento do câncer, o Brasil poderia desenvolver mais estratégias de comunicação e compartilhamento de informações para melhorar a conscientização pública sobre a prevenção e rastreamento do câncer e a educação da população sobre saúde. Desde 2002, o Ministério da Saúde do Brasil investe anualmente em ações de conscientização sobre medidas de prevenção do câncer, como por meio da Campanha Outubro Rosa. A campanha consiste em iluminar edifícios e monumentos que transmitam a mensagem “A prevenção é necessária”, ao mesmo tempo que promove o estilo de vida saudável das mulheres, incentiva a vacinação contra o HPV, gera superação do medo ou estigma associado ao câncer, entre outros temas.
Os municípios, com apoio do estado e do Governo Federal, atuam na promoção de exames de rastreamento, por meio de campanhas em mídia impressa, redes sociais e mídia local. Em determinados períodos do ano, alguns municípios implantam unidades móveis, que vão às comunidades das regiões mais distantes do país como forma de aumentar o acesso ao rastreio, diagnóstico e tratamento. Além disso, o INCA desenvolveu manuais ou folhetos que são enviados às equipes de APS todos os anos para informar o público da comunidade e do trabalho sobre estilos de vida saudáveis para prevenir o câncer e a importância da detecção precoce. O INCA também desenvolve vídeos e material escrito que é divulgado publicamente em sites e redes sociais.
Sundhed.dk, o portal e-saúde dinamarquês lançado em 2003, é o site oficial dos serviços públicos de atenção à saúde dinamarqueses que permite que pacientes e profissionais de saúde encontrem informações e se comuniquem. É um portal público online 24 horas por dia, 7 dias por semana, que coleta e distribui informações sobre atenção à saúde entre cidadãos e profissionais de saúde. Em uma parte segura do portal, o paciente tem acesso a:
Dados de saúde pessoais sobre tratamentos e anotações de registros hospitalares, informações sobre medicamentos, resultados de exames laboratoriais, dados de vacinação e visitas ao clínico geral;
Vários serviços eletrônicos, incluindo marcação de consultas com os clínicos gerais, renovações de receitas e comunicação eletrônica com o clínico geral;
Informações sobre o tempo de espera em todos os hospitais públicos e avaliações dos hospitais em termos de qualidade da experiência do paciente;
Esse portal reúne todo o setor de atenção à saúde dinamarquês e oferece ambiente acessível para os cidadãos e profissionais de saúde se encontrarem e trocarem informações de forma eficiente. Ao atender os cidadãos e os profissionais de saúde, os portais visam a permitir que os dois trabalhem em conjunto com base nos mesmos dados. Isso empodera o cidadão e dá aos profissionais de saúde melhores ferramentas para melhorar a qualidade no atendimento (OCDE, 2013[34]; European Observatory on Health Systems and Policies and Petersen, 2019[42]).
Como o compartilhamento sistemático de informações relacionadas ao câncer é limitado, especialmente para câncer sem programas de rastreamento, o Brasil também poderia desenvolver melhor estratégias de compartilhamento de informações para ajudar os pacientes a buscar atendimento, incluindo serviços de diagnóstico de câncer, no lugar certo e na hora certa. Nesse contexto, número crescente de países da OCDE desenvolveu plataformas de compartilhamento de informações para melhor envolver e capacitar os pacientes a cuidar de sua própria saúde e navegar pelos sistemas de atenção à saúde em relação às suas condições físicas. Por exemplo, alguns países da OCDE, incluindo a Dinamarca (ver Quadro 3.3), Inglaterra e Estônia, desenvolveram plataforma como site ou conta e-Saúde para compartilhar informações baseadas em indícios sobre atenção à saúde para diferentes doenças, incluindo o câncer em todo o percurso do paciente, com o objetivo de promover a educação sobre saúde da população e apoiá-la na busca por atendimento, incluindo rastreio de câncer, diagnóstico e tratamento adequado em tempo hábil.
3.3.1. A hipertensão é um dos principais fatores de risco à saúde no Brasil
A hipertensão ou pressão alta se manifesta causando dores de cabeça, sangramento nasal ou dificuldade para respirar. Se não for tratada, a hipertensão pode contribuir para o desenvolvimento de problemas cardiovasculares mais sérios, como doença renal, acidente vascular cerebral e infarto do miocárdio. A ausência de hipertensão é resultado da adoção de comportamentos saudáveis, como atividade física e dietas adequadas. Quando a hipertensão se desenvolve, ela pode ser controlada com medicamentos, bem como com ajustes no estilo de vida. Este indicador é, portanto, um substituto da promoção da saúde e serviços médicos, geralmente prestados na APS (WHO, 2019[43]).
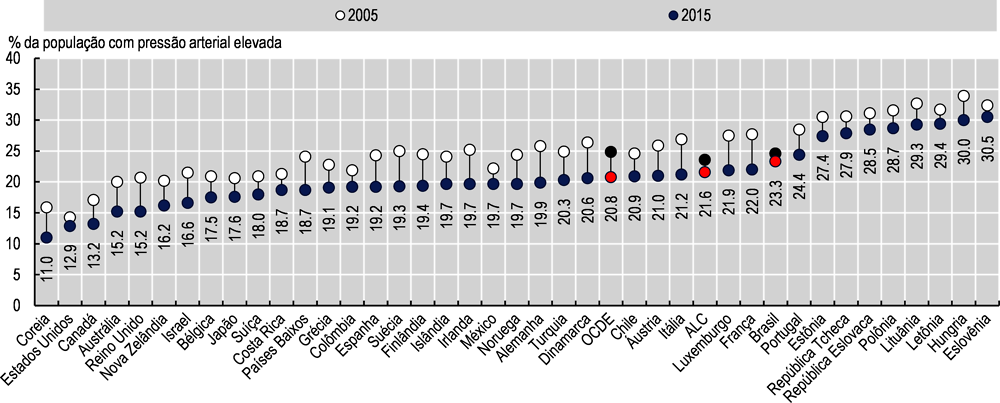
Em 2015, a prevalência média de pressão arterial elevada no Brasil foi de 23,3% - superior à média da OCDE de 20,8% e da média da ALC de 21,6%. Entre 2005 e 2015, todos os países da OCDE reduziram a prevalência de pressão arterial elevada com uma redução média de -16,4%. O Brasil também reduziu essa prevalência, mas apenas em -5,3%, uma redução menor do que todos os países da OCDE (Imagem 3.11). Alterações nos fatores de risco e melhorias na detecção e tratamento da pressão arterial elevada contribuíram, pelo menos parcialmente, para essas reduções gerais, mas outros fatores, como melhorias na nutrição da primeira infância e disponibilidade de frutas e vegetais durante todo o ano, também podem explicar essa realidade (Zhou et al., 2017[44]).
Espera-se que a APS mantenha as pessoas bem, fornecendo ponto consistente de cuidado em longo prazo, tratando as condições mais comuns, adaptando e coordenando os cuidados para aqueles com múltiplas necessidades de atenção à saúde e apoiando o paciente na autoeducação e autogestão. Dessa forma, um bom desempenho da APS pode reduzir as taxas de internações hospitalares por diversas doenças, entre elas hipertensão e diabetes. No Brasil, a taxa de internação hospitalar por hipertensão era de 48 por 100.000 pessoas em 2019, o que é menos da metade da média da OCDE de 105, mas superior à média da ALC de 39 (Imagem 3.12).
De acordo com estudo recente que analisou a pressão arterial sistólica elevada (HSBP) no Brasil, a prevalência de HSBP em 2017 foi de 18,9%, com uma taxa de aumento anual de 0,4%, enquanto as taxas de mortalidade padronizadas por idade atribuíveis a HSBP diminuíram de 189,2 (95% UI 168,5-209,2) a 104,8 (95% UI 94,9-114,4) mortes por 100.000 de 1990 a 2017. No entanto, o número total de mortes atribuíveis ao HSBP aumentou 53,4% e a HSBP passou da terceira para a primeira posição, como o principal fator de risco para mortes no período. Em relação ao total de anos de vida ajustados por deficiência (DALYs), a HSBP passou da quarta causa em 1990 para a segunda causa em 2017 (Nascimento et al., 2020[45]).
3.3.2. Quando comparado aos países da OCDE, a diabetes já tem uma taxa maior de doença no Brasil.
Níveis elevados de açúcar no sangue podem levar ao desenvolvimento de diabetes. A glicemia em jejum contribui para diagnosticar e monitorar o diabetes e pode ser controlada devido ao tratamento eficaz com medicamentos para redução da glicose e como resultado de atividades de promoção da saúde. A APS tem papel central na realização dessas ações (WHO, 2019[43]).
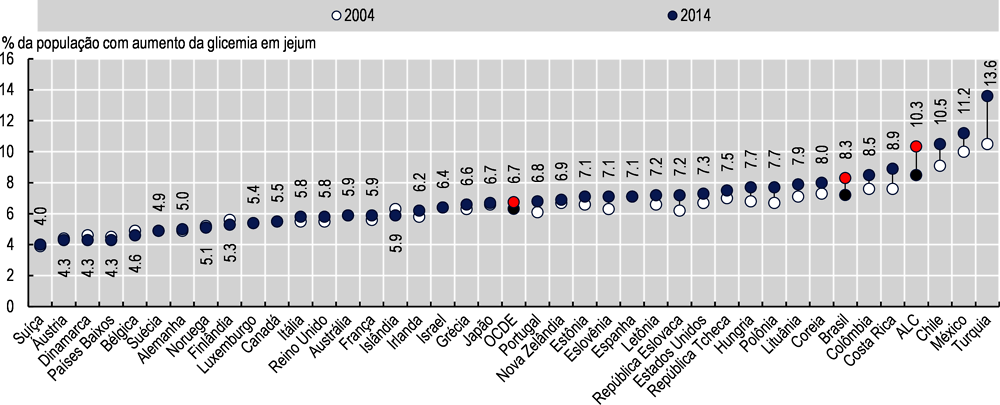
No Brasil, 8,4% da população tinha glicemia em jejum acima do recomendado em 2014, acima da média de 6,7% nos países da OCDE. É importante ressaltar que, entre 2004 e 2014, o Brasil registrou um dos maiores aumentos em sua população com glicemia acima do recomendado, com um aumento de 15,3% (Imagem 3.13). Apenas a Turquia, Costa Rica, República Eslovaca e Chile tiveram aumentos maiores entre os países da OCDE, evidenciando tendência preocupante no Brasil.
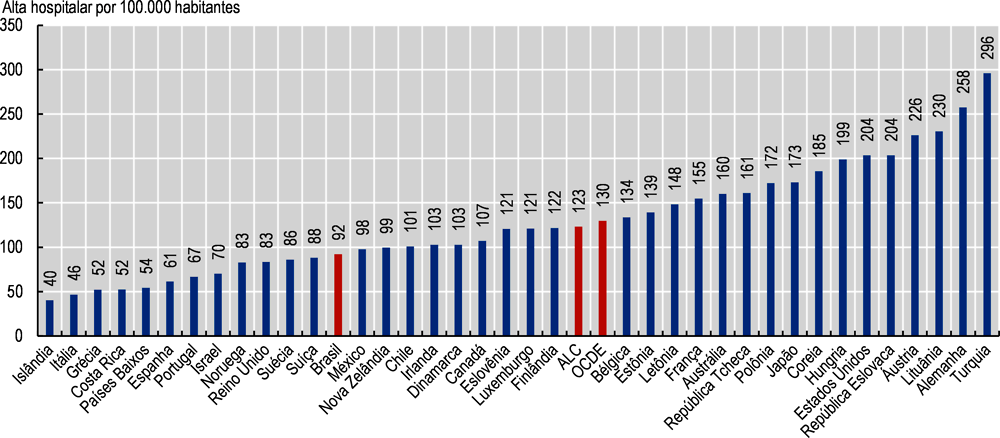
Conforme afirmado anteriormente, uma APS com bom desempenho pode controlar e reduzir o número de internações hospitalares por diabetes. No Brasil, a taxa de internação hospitalar por diabetes em 2019 foi de 92 internações por 100.000 pessoas, abaixo da média da OCDE de 130 e da média da ALC de 123 (Imagem 3.14). As diferenças entre o Brasil e os países da OCDE em termos de acesso a cuidados hospitalares e os perfis de doenças crônicas não transmissíveis permanecem como alguns dos fatores a serem estudados mais a fundo com o objetivo de compreender essas diferenças (OCDE/The World Bank, 2020[46]).
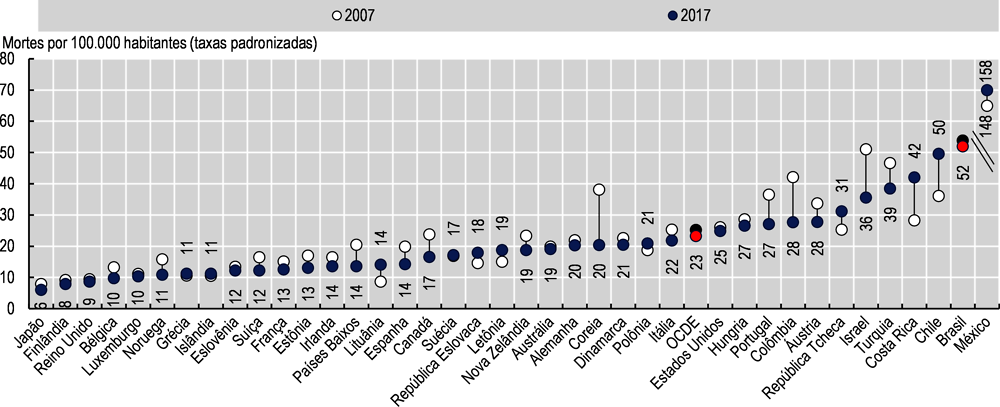
A mortalidade por diabetes no Brasil atingiu 50 mortes por 100.000 pessoas em 2019, maior do que a média da OCDE de 22, e apenas menor do que na Costa Rica e no México. Entre 2007 e 2019, a mortalidade por diabetes foi reduzida em 9,8%, maior do que a redução média de 7,8% entre os países da OCDE (Imagem 3.15).
O impacto da diabetes no sistema de saúde brasileiro é elevado: em 2014, 313.273 internações foram devido a diabetes em adultos (4,6% do total de internações de adultos), representando US$ 264,9 milhões (Quarti Machado Rosa et al., 2018[47]). O custo médio de uma internação de adulto com diabetes foi de US$ 845, 19% maior do que a internação sem diabetes. As internações por doenças cardiovasculares relacionadas ao diabetes representaram a maior proporção dos custos (47,9%), seguidas das complicações microvasculares (25,4%) e da diabetes propriamente dita (18,1%). Outro estudo que analisa a taxa da diabetes no Brasil constatou que a prevalência geral estimada de diabetes em 2017 era de 4,4% (95% UI 4,0-4,9%). Enquanto a prevalência bruta de diabetes tipo 1 permaneceu relativamente estável desde 1990, a prevalência do tipo 2 aumentou 30% para homens e 26% para mulheres. Em 2017, aproximadamente 3,3% de todos os DALYs foram devido à diabetes e 5,9% à hiperglicemia. A prevalência e a mortalidade por diabetes foram maiores na região Nordeste e cresceram mais rapidamente nas regiões Norte, Nordeste e Centro-Oeste. As projeções futuras sugeriram que a taxa de mortalidade por diabetes aumentará 144% até 2040, mais de duas vezes o aumento esperado na taxa bruta de doenças em geral (54%). Em 2040, projeta-se que a diabetes será a terceira principal causa de morte no Brasil e a hiperglicemia seu terceiro principal fator de risco em termos de mortes (Duncan et al., 2020[48]).
3.3.3. O rastreamento de hipertensão e diabetes no Brasil está incorporada a um programa mais amplo de check-up na APS
De modo geral, os exames básicos de saúde e o rastreamento de risco de doenças crônicas no Brasil dependem de equipes de saúde da família da APS e, predominantemente, de triagens oportunísticas. A pressão sanguínea e a glicose sanguínea são geralmente verificadas durante os check-ups básicos na APS a respeito de doenças crônicas. Esses exames também incluem outras medidas, como colesterol, rastreamento de doenças cardiovasculares com base na idade, histórico familiar e fatores de risco, como índice de massa corporal (IMC), que podem ajudar a diagnosticar pessoas em risco de doenças crônicas ou diagnosticar doenças crônicas em seus estágios iniciais, quando podem ser tratados com menos complicações.
Uma diretriz oficial de rastreamento de doenças crônicas não transmissíveis do Ministério da Saúde foi publicada em 2010 e é válida até hoje (Ministério da Saúde, 2010[49]). Tanto para hipertensão quanto para diabetes, as populações-alvo de rastreio são bastante amplas. O rastreio de hipertensão é recomendado para adultos (maiores de 18 anos de idade) sem o conhecimento de que são hipertensos. Sugere-se realizar rastreamento a cada dois anos de pessoas com pressão arterial abaixo de 120/80 mmHg e rastreamento anual se a pressão arterial sistólica estiver entre 120 e 139 mmHg ou pressão arterial diastólica entre 80 e 90 mmHg. Para diabetes, a diretriz recomenda o rastreamento em adultos assintomáticos com pressão arterial sustentada maior que 135/80 mmHg e não se aplica a outros critérios de rastreamento, como obesidade, histórico familiar ou faixa etária. Além disso, existem cadernos específicos (Cadernos de atenção básica) para a gestão da hipertensão (Ministério da Saúde, 2013[50]) e um protocolo recente para diabetes (CONITEC, 2020[51]), que também consideram um componente de rastreamento. Para ambas as doenças, o modelo de saúde da família propõe que profissionais de saúde capacitados atuem de forma interdisciplinar, articulem-se com os usuários dos serviços e assumam a responsabilidade pela garantia da atenção à saúde abrangente. Por exemplo, para o diabetes, isso inclui rastreamento, classificação e diagnóstico, junto com uma avaliação inicial, orientação sobre estilo de vida saudável e consultas médicas de acompanhamento. Também considera o controle da glicemia e o tratamento com ou sem medicamentos, a prevenção e a gestão de complicações agudas e crônicas, os cuidados com os pés e com a atenção à saúde odontológica (Ministério da Saúde, 2013[52]).
Um estudo avaliou a continuidade dos cuidados com a hipertensão na APS do Brasil e identificou que mais de um terço da população adulta brasileira tinha hipertensão medida ou diagnóstico prévio. Quase 90% deles tiveram contato recente com o sistema de saúde, mas apenas 65% tinham conhecimento de sua condição. Destes, apenas 62% procuraram atendimento regular para hipertensão, mas, deles, 92% receberam tratamento. O controle da hipertensão era de 33% no geral, mas aumentou para 57% entre aqueles que passaram por todas as etapas dos cuidados contínuos, mostrando a importância de equipes de APS de alto desempenho (Macinko, Leventhal and Lima-Costa, 2018[53]).
Em relação à infraestrutura de informações de saúde, o Brasil desenvolveu sistema específico de registro e monitoramento para hipertensos e diabéticos: o HIPERDIA. É gerenciado pelo Ministério da Saúde, por meio da Secretaria de Serviços de Atenção à Saúde, em articulação com as Secretarias Estaduais e Municipais de Saúde. Os municípios integrantes do Programa Nacional de Assistência Farmacêutica para Hipertensão e Diabetes Mellitus enviam, por meio do sistema HIPERDIA, informações sobre o cadastro e acompanhamento de portadores dessas doenças. Todas essas informações são processadas e disponibilizadas pelo DATASUS do Ministério da Saúde (Ministério da Saúde, 2021[54]).
No contexto da pandemia de COVID-19 e reconhecendo que as pessoas com DCNT correm maior risco, o Ministério da Saúde emitiu diretrizes específicas para apoiar esse grupo da população por meio da APS. O objetivo era acompanhar essa população com regularidade adequada, visando a estabilidade clínica e reduzindo as chances de desfechos desfavoráveis durante o período pandêmico. Dentre outros componentes, a estratégia incluiu a identificação, registro e estratificação de risco de pessoas com obesidade, diabetes e/ou hipertensão arterial sistêmica por meio de ações de vigilância e diagnóstico oportuno da população aderente. Além disso, a identificação precoce e a priorização do acompanhamento e monitoramento desses indivíduos com síndrome de influenza ou com suspeita ou confirmação de COVID-19. A resposta incluiu a assistência terapêutica multiprofissional, a prevenção da transmissão do coronavírus em indivíduos com obesidade, diabetes e/ou hipertensão e a implantação de ações intersetoriais e comunitárias de promoção da saúde, considerando a situação epidemiológica da COVID-19 em cada território (Ministério da Saúde, 2020[55]). Todas essas estratégias são bem-vindas, uma vez que as pessoas com doenças crônicas não transmissíveis enfrentam uma “dupla ameaça”: são mais vulneráveis a complicações e morte por COVID-19 e sofrem efeitos indiretos sobre a saúde decorrentes de interrupções nos cuidados essenciais (Quadro 3.4).
Nos países da OCDE, pessoas com doenças crônicas existentes (incluindo câncer, doença renal crônica, doença pulmonar obstrutiva crônica, doenças cardíacas, estado imunocomprometido, diabetes tipo 2, doença falciforme e obesidade) são a população de pacientes mais afetada na pandemia de COVID-19. Pessoas com condições crônicas estão enfrentando uma “dupla ameaça”: são mais vulneráveis a complicações e morte por COVID-19 e sofrem efeitos indiretos sobre a saúde decorrentes de interrupções nos cuidados essenciais:
Em primeiro lugar, as pessoas que vivem com certas condições crônicas correm maior risco de sintomas graves de COVID-19. No início da pandemia, foi demonstrado na China que os pacientes mais velhos e aqueles com condições crônicas eram mais propensos a ter uma condição de COVID-19 grave a crítica, a apresentar deterioração de sua condição de saúde e a morrer de COVID-19 (Zhang and et, 2020[56]). Pesquisas nos Estados Unidos, Itália e Reino Unido confirmam desfechos de COVID-19 mais graves e maior risco de hospitalização entre pacientes com condições de saúde subjacentes (OCDE, 2021[57]);
Em segundo lugar, as pessoas que vivem com condições crônicas também enfrentam impactos indiretos da pandemia devido a interrupções na continuidade dos cuidados ou tratamento prévio. O lockdown e o medo de contaminação nas salas de espera levaram muitos pacientes a desistir do atendimento, incluindo aqueles que requerem acompanhamento regular de doenças crônicas, como o câncer (OCDE, 2021[57]). Por exemplo, na Inglaterra, os encaminhamentos urgentes da APS para pessoas com suspeita de câncer diminuíram quase 80% em comparação com os níveis anteriores à crise de COVID-19. Na França, o número de diagnósticos de câncer diminuiu de 35% a 50% em abril de 2020, em comparação com abril de 2019. As triagens preventivas de câncer nos Estados Unidos referentes a câncer de mama, câncer de cólon e câncer do colo do útero também caíram entre 86% e 94% em março de 2020 em comparação com os volumes médios em 2017-19. Na Austrália, houve cerca de 145.000 menos mamografias de rastreio realizadas pela BreastScreen Australia de janeiro a junho de 2020 em comparação com janeiro a junho de 2018.
Uma APS forte tem a capacidade de mitigar esses efeitos indiretos durante a pandemia, mas também de reduzir a pressão sobre todo o sistema de saúde, fornecendo atenção integral e preventiva.
Fonte: (OCDE, 2021[57]), Strengthening the frontline: How primary health care helps health systems adapt during the COVID-19 pandemic. OECD Policy Responses to Coronavirus (COVID-19).
3.3.4. A melhoria da qualidade e os esquemas de pagamento por desempenho na APS do Brasil incluíram o controle da hipertensão e diabetes
As atividades de checkup integram a Carteira de Serviços de Atenção Primária à Saúde - APS, a qual recebe financiamento do governo federal repassado aos estados e municípios, sendo esses órgãos responsáveis pela gestão da prestação dos serviços. Em 2011, o Ministério da Saúde criou o Programa de Melhoria do Acesso e da Qualidade da APS (PMAQ) com o objetivo de ampliar o acesso e a qualidade da atenção oferecida por meio de incentivos financeiros direcionados à gestão municipal da saúde, condicionados a acordos formais de compromissos e avaliação de indicadores acordados entre equipes de APS, gestores de serviços municipais de saúde e o Ministério da Saúde (ver Capítulo 4). Como parte do PMAQ, a avaliação das eSFs incluiu tópicos como detecção precoce de hipertensão, exames laboratoriais de diabetes e recargas de prescrição para usuários em cuidados/programas continuados como hipertensão e diabetes sem a necessidade de marcar consultas médicas.
Mais recentemente, o novo Programa Previne Brasil, implementado em 2020, inclui um componente de remuneração por desempenho, que recompensa o desempenho vinculado a sete indicadores (ver Capítulo 4). Dois deles estão relacionados à hipertensão e diabetes (Ministério da Saúde, 2020[58]):
Indicador 6: Porcentagem de pessoas com hipertensão que tiveram a pressão arterial verificada em cada semestre.
Indicador 7: Porcentagem de pessoas com diabetes com solicitação de hemoglobina glicada.
Embora esses indicadores não estejam diretamente relacionados ao rastreamento, mas ao acompanhamento dos pacientes que já têm a doença, é importante destacar que os pacientes diagnosticados podem se beneficiar desse incentivo. No entanto, seria importante monitorar como esse programa poderia influenciar as atividades de rastreamento de hipertensão e diabetes na APS.
3.3.5. A prevenção secundária de hipertensão e diabetes no Brasil deve ser revisada para melhorar a eficácia e eficiência de suas atividades de rastreamento
O Brasil poderia desenvolver rastreamento de hipertensão de base populacional e de diabetes tipo 2 visando a grupos populacionais de alto risco
Vários países da OCDE possuem exames de saúde referentes a doenças crônicas, geralmente direcionados a grupos específicos da população, realizados periodicamente, por exemplo, a cada cinco anos, e às vezes fornecidos por profissionais de atenção à saúde que não sejam médicos. Na Estônia, exames de saúde e orientações são fornecidos por enfermeiras da família para pessoas com idade entre 40 e 60 anos com hipertensão ou diabetes (Habicht et al., 2018[59]) e, em 2007, a Coreia introduziu o Programa Nacional de Rastreio para Idades de Transição, visando a pessoas de 40 e 66 anos (Kim et al., 2012[60]). Na Inglaterra, o NHS Health Check foi introduzido para pessoas com idades entre 40 e 74 anos em 2009 e uma carta-convite é enviada a cada cinco anos para aqueles que ainda não têm diabetes, doença cardíaca ou renal ou não tiveram derrame, para rastreá-los quanto ao risco de desenvolver doenças crônicas, incluindo doenças cardíacas, derrames, doenças renais, diabetes tipo 2 ou demência (disponível apenas para maiores de 65 anos). Esse check-up é frequentemente realizado por enfermeira ou assistente de atenção à saúde (Gmeinder, Morgan and Mueller, 2017[61]; NHS, 2018[62]). A Tabela 3.4 mostra as recomendações de rastreamento de hipertensão a partir de diretrizes baseadas em indícios selecionados, juntamente com a recomendação mais recente no Brasil.
No entanto, uma revisão recente encomendada pela OMS Europa descobriu que os indícios disponíveis não dão base para a recomendação sobre o rastreio sistemático da hipertensão em nível populacional (Eriksen et al., 2021[63]). Em vez de recomendar o rastreio sistemático, a alternativa preferida seria visar aqueles na APS que podem estar em risco mais alto devido à idade ou à presença de um fator de risco (ou seja, detecção de casos). No Brasil, estudo que identificou os principais fatores de risco para o desenvolvimento de hipertensão constatou que a prevalência aumentou com a idade, baixa escolaridade, aumento do índice de massa corporal e cintura abdominal e excreção urinária de sódio (Cipullo et al., 2010[64]). Esse tipo de estudo na população brasileira pode ajudar a definir o grupo-alvo para orientar futuras recomendações de rastreamento de hipertensão.
Da mesma forma que acontece com a hipertensão, o rastreio de diabetes nos países da OCDE é normalmente incorporado em exames de saúde mais gerais. Na Austrália, por exemplo, os médicos da APS podem fornecer avaliações de saúde para pessoas que correm o risco de desenvolver doença crônica. Essa avaliação é fornecida a pessoas com idade entre 45 e 49 anos, uma vez que tenham pelo menos um fator de risco (hábitos de vida ou histórico familiar) para o desenvolvimento de uma doença crônica, como diabetes tipo 2 ou doença cardíaca. A avaliação também é fornecida a pessoas com 75 anos ou mais com intervalo de 12 meses ou mais (Department of Health, 2014[65]). Visando a reduzir a prevalência de doenças relacionadas ao estilo de vida, incluindo câncer, doenças cardiovasculares e diabetes, o Japão introduziu o check-up de saúde específico (Tokutei kenshin) para a população com idade entre 40 e 74 anos em 2008. Todas as seguradoras do sistema de saúde japonês são obrigadas a fornecer exame de saúde específico para pessoas nessa faixa etária todos os anos, pois elas são consideradas como de maior risco de desenvolver doenças relacionadas ao estilo de vida. As seguradoras precisam fornecer conjunto padrão nacional de itens de check-up de saúde (OCDE, 2019[40]). A Tabela 3.5 mostra as recomendações de rastreamento de diabetes mellitus tipo 2 a partir de diretrizes baseadas em indícios selecionados, juntamente com a recomendação mais recente no Brasil.
De acordo com as evidências científicas mais recentes, o excesso de rastreamento (por exemplo, por ter uma população-alvo muito ampla) provavelmente não melhorará os resultados de saúde da população e pode ser uso ineficiente de recursos. Portanto, o Brasil pode ter como meta programas populacionais de rastreamento de hipertensão e diabetes tipo 2 bem direcionados, com base em sua epidemiologia nacional, características do sistema de saúde e análise de custo-efetividade, como forma eficaz de identificar e gerenciar doenças crônicas.
Fortalecer os itinerários terapêuticos com uma perspectiva centrada nas pessoas
O rastreamento de hipertensão e diabetes deve ser apenas o primeiro passo em um itinerário claro de gerenciamento de doenças no Brasil. Os itinerários terapêuticos de doenças crônicas, que podem ser incorporadas às diretrizes clínicas, devem estar disponíveis para todas as doenças crônicas de alta prevalência, para dar orientação aos profissionais de atenção à saúde e pacientes sobre as expectativas dos cuidados que devem ser prestados e recebidos. As duas diretrizes clínicas existentes no Brasil (Ministério da Saúde, 2013[50]; CONITEC, 2020[51]) representam passo muito positivo para o desenvolvimento de diretrizes de melhores práticas com itinerários terapêuticos explícitos. No momento, esses itinerários estão focados em informações para profissionais de saúde na APS, mas poderiam ser expandidos para integrar outros prestadores de cuidados (por exemplo, especialistas ou grupos de apoio ao paciente) e serem produzidos em um formato amigável ao paciente.
Os itinerários terapêuticos de doenças crônicas, produzidos em formatos voltados para o paciente e para o clínico, devem estabelecer claramente as responsabilidades profissionais dos profissionais de saúde em diferentes estágios da doença. Esses itinerários podem ser usados para definir expectativas de qualidade para doenças crônicas, como diabetes e doenças cardiovasculares, e padronizar a qualidade do atendimento em todo o Brasil. As vias também podem ser usadas para esclarecer os papéis esperados para diferentes prestadores de cuidados. Na área do diabetes, os itinerários clínicos podem ajudar ao: (1) auxiliarem na avaliação sistemática da apresentação clínica do paciente e dos fatores de risco; (2) escolherem as intervenções comportamentais e medicamentosas mais adequadas; e (3) fornecerem um cronograma para acompanhamento e monitoramento do paciente. Em suma, os itinerários terapêuticos ajudarão na coordenação de cuidados e acompanhamento (Wong, 2017[71]).
A Inglaterra desenvolveu itinerários mais complexos, que incluem expectativas em diferentes estágios da doença, os papéis para diferentes prestadores de cuidados, intervenções-chave e resultados desejados (NHS England, 2018[72]). O itinerário terapêutico "NHS RightCare: Diabetes” da Inglaterra inclui, por exemplo, uma expectativa de que o planejamento de cuidados e uma revisão anual ocorram para pacientes com diabetes tipo 1 e tipo 2, e o itinerário inclui links para documentação de suporte para ajudar no planejamento de cuidados. Na Inglaterra, a expectativa é que muitos cuidados com o diabetes sejam fornecidos por equipes multidisciplinares em ambientes de cuidados comunitários, e o itinerário inclui detalhes dos serviços que a equipe normalmente forneceria (educação do paciente, aconselhamento sobre gravidez, equipe de proteção dos pés) (ver Imagem 3.16).
Além de estabelecer itinerários claros de gerenciamento de doenças crônicas, é necessário garantir que outras alavancas dentro do sistema estejam efetivamente alinhadas com esse meio. Isso inclui o alinhamento de incentivos de pagamento e reembolso, bem como garantir que os profissionais de saúde tenham as ferramentas e capacidades de que precisam para assumir as responsabilidades que se esperam deles.
Criar mais capacidade na APS para rastreio e controle de hipertensão e diabetes por meio da expansão do papel dos profissionais de saúde
Para fortalecer a capacidade de prevenção e impacto, o Brasil deve procurar aumentar a capacidade na APS. Uma maneira que vários países da OCDE encontraram para aumentar a capacidade está relacionada à transferência de tarefas ou expansão do papel de outros profissionais de saúde (Quadro3.5). Explorar se há maneiras de outros profissionais de saúde - por exemplo, enfermeiros, nutricionistas ou farmacêuticos - desempenharem papel na realização de algumas dessas atividades essenciais de prevenção é certamente uma possibilidade para o Brasil.
Por exemplo, quando se trata de diabetes, os enfermeiros podem ter a capacidade e o treinamento para realizar uma avaliação inicial do paciente, incluindo a garantia da capacidade de fazer testes de açúcar no sangue em todas as clínicas e trabalhar em conjunto com médicos e outros membros da equipe no acompanhamento de atividades. Em termos gerais, os cuidados prestados por enfermeiras demonstraram qualidade de atendimento equivalente ou melhor em uma grande variedade de medidas de desfechos clínicos para condições crônicas, incluindo diabetes (Maier, Aiken and Busse, 2017[73]). Uma análise sistemática constatou que a assistência de enfermagem foi pelo menos tão eficaz quanto a assistência médica no fornecimento de prevenção secundária a pacientes com condições crônicas, onde 84% dos parâmetros de desfecho não mostraram diferenças estatisticamente significativas, e para os 16% restantes, os desfechos de prevenção secundária melhoraram no grupo de enfermeiras, principalmente entre pacientes com diabetes. Neste grupo de pacientes, o cuidado do enfermeiro foi superior na prevenção do aparecimento de doenças cardíacas e reduziu o risco cardiovascular (Martínez-González et al., 2015[74]).
Os farmacêuticos comunitários também podem ser considerados para políticas de transferência de tarefas e, na maioria dos países da OCDE, seu papel evoluiu substancialmente nos últimos anos. Os farmacêuticos podem desempenhar papel fundamental em aconselhar os pacientes e apoiá-los para lidar com suas necessidades de saúde e gerenciar seus cuidados. Análises sistemáticas recentes mostraram que o envolvimento do farmacêutico nos cuidados pode melhorar os desfechos de saúde para condições crônicas, como diabetes e hipertensão (Pousinho et al., 2016[75]), podendo também se tornar econômico para sistemas de saúde (Wang, Yeo and Ko, 2016[76]). No Brasil, o farmacêutico parece não ter grande presença nas equipes da APS, afirmando-se até que o isolamento do farmacêutico na APS prevalece (Barberato, Scherer and Lacourt, 2019[77]). Portanto, tal política exigiria análise e planejamento minuciosos para definir a melhor maneira de investir na introdução de farmacêuticos comunitários nas equipes de APS do Brasil.
Como em outros países da OCDE, a França está atualmente estendendo o papel de enfermeiras e farmacêuticos, o que é visto como uma alavanca política fundamental para melhorar o acesso em áreas carentes, onde o número de médicos da APS está diminuindo. O novo decreto que estabelece a profissão de Enfermeiro Avançado (Infirmière en Pratique Avancée) foi emitido em junho de 2018. O profissional de enfermagem avançado trabalhará em uma equipe da APS para gerenciar pacientes com condições crônicas e assumir a liderança na prevenção e coordenação.
Paralelamente, o papel dos farmacêuticos comunitários está aumentando gradativamente. Os farmacêuticos comunitários podem realizar três testes de orientação diagnóstica rápida: o teste de glicose no sangue capilar para rastreamento da diabetes; testes orofaríngeos para gripe; e o teste de amigdalite estreptocócica do grupo A. O objetivo é determinar se o tratamento com antibióticos é necessário e se é necessária uma consulta médica para obter uma receita. O farmacêutico comunitário também pode participar de programas de rastreamento pontual de doença pulmonar obstrutiva crônica (DPOC). Por último, os farmacêuticos na França agora podem realizar a vacinação contra a gripe.
Fonte: Percebendo o potencial da APS (OCDE, 2020[78]), https://dx.doi.org/10.1787/a92adee4-en.
O sistema de informação de saúde precisa ser desenvolvido ainda mais para apoiar o rastreio de base populacional direcionada para melhor monitoramento e avaliação
O rastreio e outras atividades de atenção à saúde para hipertensão e diabetes têm o potencial de gerar uma riqueza de informações valiosas sobre saúde que podem ser usadas tanto para melhor gerenciar a saúde da população, projetar e direcionar intervenções de saúde pública mais eficazes, quanto para pesquisas. No entanto, o HIPERDIA, sistema de informação em saúde do Brasil para hipertensão e diabetes na APS, não coleta informações sobre rastreamento e também não é capaz de captar a trajetória de atendimento de cada paciente (por exemplo, encaminhamentos, tempos de espera, consultas com especialistas, exames laboratoriais, medicamentos etc.). Também é difícil para as equipes de APS analisar e agir com base nessas informações, pois não recebem feedback regular e os pacientes não podem ter acesso aos seus dados pessoais de saúde. Também é difícil para o sistema conectar-se a outros bancos de dados, como hospitalizações, registros de óbitos etc.
Muitos países da OCDE têm registros médicos digitais padronizados nacionalmente e são capazes de usar dados atualizados para monitorar e avaliar o sistema de saúde, extraindo automaticamente dados de registros clínicos eletrônicos. Por exemplo, um conjunto de países que inclui Canadá, Coréia, Cingapura, Dinamarca, Finlândia, Israel, República Tcheca, Noruega, Nova Zelândia, Reino Unido (Inglaterra, Escócia e País de Gales) e Suécia e regularmente vinculam informações de diferentes conjuntos de dados nacionais, como hospitais e dados de pacientes internados em hospitais psiquiátricos, registro de câncer e de mortalidade. Usando esses dados vinculados, esses países são capazes de monitorar ativamente a qualidade e o desempenho do sistema de saúde.
Para monitorar e desenvolver estratégias de prevenção secundária, o Brasil precisa desenvolver sistema de informação em saúde que permita vincular diferentes fontes de dados. As experiências de outros países da OCDE no desenvolvimento de sistema de informação de saúde forte dentro de uma estrutura de governança de dados que proteja a privacidade das informações de saúde dos pacientes, a qual é apresentada em OCDE (2019[79]), seria útil para o Brasil seguir tais caminhos.
Um sistema de informação de saúde mais forte também poderia facilitar a racionalização dos esforços para convidar a população-alvo para o rastreamento de hipertensão e diabetes. Atualmente, essas triagens são em grande parte oportunísticas e não há informações sobre quem as está recebendo. Além disso, não é possível aos municípios ou equipes de APS identificar a quem enviar os convites. O atual processo de registro da população na APS do Brasil representa uma oportunidade para o desenvolvimento de programas organizados de rastreamento. O Brasil poderia enviar cartas-convite personalizadas, sem duplicação, apenas para quem faz parte da população-alvo e não está em tratamento, e para quem não acompanhou resultados preocupantes de um check-up anterior. Essas abordagens personalizadas e direcionadas são consideradas mais eficazes no recrutamento de pessoas que precisam de check-ups de saúde (Bunten et al., 2020[80]).
No futuro, o Brasil poderia considerar o financiamento por pacotes de serviços como mecanismo para melhorar a gestão de condições crônicas na APS
O Brasil inovou recentemente em seu esquema de financiamento na APS com o programa Previne Brasil. Para o futuro, outra alternativa a explorar são os pagamentos em pacote, em particular, para condições crônicas. Eles consistem em um pagamento por paciente com doença crônica para cobrir o custo de todos os serviços de atenção à saúde prestados por todos os provedores durante um período específico. Tal sistema foi introduzido nos países da OCDE para incentivar a coordenação de cuidados entre prestadores ou fornecer um conjunto mais amplo de cuidados (por exemplo, educação, verificações regulares, verificações específicas ocasionais). O financiamento por pacotes de serviços pode encorajar a colaboração dentro de cada local de atendimento ou mesmo entre locais diferentes. Essa modalidade também pode contribuir para uma maior padronização do atendimento exigindo, por exemplo, a adesão aos critérios de qualidade, ou fortalecer a disponibilidade de dados por intermédio da exigência da coleta de indicadores de monitoramento ou integração de sistemas de dados em todos os ambientes de atendimento e controle de custos no geral (OCDE, 2016[81]).
Embora o desenho e as características dos financiamentos por pacotes de serviços difiram entre os países da OCDE, os modelos desenvolvidos na Austrália e no Canadá podem ser de particular interesse para o Brasil e outros países. Nesses países, o pagamento em pacote é responsável pela complexidade do paciente, que é pré-requisito importante para incentivar a participação de prestadores de APS (OCDE, 2020[78]).
No Brasil, a mortalidade por câncer não foi reduzida na última década, enquanto o câncer de mama e de colo do útero reduziram suas chances de sobrevida mais longa após o diagnóstico. Essa constatação vai na direção oposta aos resultados obtidos nos países da OCDE, exigindo uma ação urgente para reverter essas tendências. Embora o rastreio do câncer de mama e do colo do útero tenha aumentado nos últimos anos, sua cobertura permanece bem abaixo dos padrões recomendados, limitando seu potencial de contribuir para melhores desfechos do câncer. Para enfrentar o ônus da doença, o Brasil fortaleceu a governança e a prestação de cuidados ao câncer, porém, ainda há muito a ser feito, com ênfase na promoção e prevenção. Há espaço para expandir a cobertura de rastreamento - notadamente desenvolvendo programas baseados na população, introduzindo convites personalizados mais sistemáticos para o rastreamento do câncer e desenvolvendo melhores estratégias de comunicação e educação com o uso de novas tecnologias. O Brasil também pode procurar expandir os esforços em novos locais de câncer, como pulmão e colo retal, uma vez que representam grande carga de doença, merecendo análise mais aprofundada dos benefícios potenciais de investir em programas nacionais de rastreamento. Enquanto isso, o desenvolvimento de sistema de rastreamento mais abrangente para o rastreamento do câncer, com informações no nível individual de cada paciente, ajudaria o Brasil na administração dos programas de rastreamento (por exemplo, garantindo cobertura efetiva da população-alvo) e seria uma rica fonte de dados para avaliar periodicamente a eficácia dos protocolos de rastreamento existentes.
Por outro lado, hipertensão e diabetes também representam fardo para a saúde da população brasileira e para o sistema de saúde. Por exemplo, a prevalência tanto da pressão arterial elevada quanto da glicemia em jejum é maior do que a média dos países da OCDE. No caso do diabetes, a mortalidade não diminuiu nos últimos anos no Brasil, ao contrário do que tem sido observado nos países da OCDE. Portanto, o Brasil poderia fortalecer suas atividades de check-up da APS ao adotar programas de rastreamento de hipertensão e diabetes tipo 2 de base populacional, visando a grupos populacionais de alto risco bem definidos. Isso vai junto com o desenvolvimento de itinerários claros de gerenciamento de doenças, onde as equipes de APS e cada paciente individual podem tomar as medidas adequadas para gerenciar sua doença. As diretrizes clínicas atuais e o registro de pacientes na APS são bons pontos de partida para continuar nessa direção. Há também espaço claro para os enfermeiros da APS desempenharem papel mais ativo na educação do paciente, promoção do rastreamento e gerenciamento de doenças, enquanto os farmacêuticos comunitários podem ser introduzidos em ações direcionadas para gerenciar essas condições crônicas. Os sistemas de informação em saúde precisam ser mais desenvolvidos a fim de fornecer mais e melhores informações às equipes e aos pacientes da APS, o que permitiria melhorar as decisões de manejo clínico na APS e capacitar os pacientes a assumir um papel de liderança em suas próprias ações de prevenção e controle.
Referências
[77] Barberato, L., M. Scherer and R. Lacourt (2019), The pharmacist in the Brazilian primary health care: Insertion under construction, Associacao Brasileira de Pos - Graduacao em Saude Coletiva, https://doi.org/10.1590/1413-812320182410.30772017.
[37] Bibbins-Domingo, K. et al. (2016), “Screening for colorectal cancer: US preventive services task force recommendation statement”, JAMA - Journal of the American Medical Association, Vol. 315/23, pp. 2564-2575, https://doi.org/10.1001/jama.2016.5989.
[80] Bunten, A. et al. (2020), “A systematic review of factors influencing nhs health check uptake: Invitation methods, patient characteristics, and the impact of interventions”, BMC Public Health, Vol. 20/1, pp. 1-16, https://doi.org/10.1186/s12889-019-7889-4.
[31] Camilloni, L. et al. (2013), Methods to increase participation in organised screening programs: A systematic review, BioMed Central, https://doi.org/10.1186/1471-2458-13-464.
[64] Cipullo, J. et al. (2010), “Hypertension prevalence and risk factors in a Brazilian urban population”, Arquivos Brasileiros de Cardiologia, Vol. 94/4, pp. 488-494, https://doi.org/10.1590/S0066-782X2010005000014.
[51] CONITEC (2020), Protocolo Clínico e Diretrizes Terapêuticas do Diabete Melito Tipo 2, Comissão Nacional de Incorporação de Tecnologias no Sistema Único de Saúde, Brasilia, http://conitec.gov.br/ (accessed on 7 March 2021).
[5] Coordenação de Prevenção e Vigilância. Divisão de Detecção Precoce e Apoio à Organização de Rede (ed.) (2016), Diretrizes brasileiras para o rastreamento do câncer do colo do útero, / Instituto Nacional de Câncer José Alencar Gomes da Silva, Rio de Janeiro, http://www.inca.gov.br (accessed on 16 February 2021).
[11] Costa, R. et al. (2018), “Trend analysis of the quality indicators for the Brazilian cervical cancer screening programme by region and state from 2006 to 2013”, BMC Cancer, Vol. 18/1, pp. 1-9, https://doi.org/10.1186/s12885-018-4047-9.
[39] CTFPHC (2016), “Recommendations on screening for lung cancer - Canadian Task Force on Preventive Health Care”, CMAJ, Vol. 188/6, pp. 425-432, https://doi.org/10.1503/cmaj.151421.
[9] Da Costa Vieira, R., A. Formenton and S. Bertolini (2017), Breast cancer screening in Brazil. Barriers related to the health system, Associacao Medica Brasileira, https://doi.org/10.1590/1806-9282.63.05.466.
[7] DATASUS (2021), Painel-Oncologia - Notas Técnicas, DATASUS, Brasil, http://tabnet.datasus.gov.br/cgi/dhdat.exe?PAINEL_ONCO/PAINEL_ONCOLOGIABR.def (accessed on 2 March 2021).
[65] Department of Health (2014), Medicare Benefits Schedule (MBS) - Health assessment for people aged 45 to 49 years who are at risk of developing a chronic disease, Department of Health, Australian Government.
[69] Diabetes Canada (2018), “Clinical Practice Guidelines for the Prevention and Management of Diabetes in Canada”, Can J Diabetes, Vol. 42/Suppl 1, pp. S1-S325.
[48] Duncan, B. et al. (2020), “The burden of diabetes and hyperglycemia in Brazil: A global burden of disease study 2017”, Population Health Metrics, Vol. 18/S1, p. 9, https://doi.org/10.1186/s12963-020-00209-0.
[25] ECIBC (2020), European guidelines on breast cancer screening and diagnosis, European Commission Initiative on Breast Cancer, https://healthcare-quality.jrc.ec.europa.eu/european-breast-cancer-guidelines (accessed on 2 March 2021).
[30] ECIBC (2020), Inviting women to subsequent rounds of screening: Letters with fixed appointment to screening, European Commission Initiative on Breast Cancer, https://healthcare-quality.jrc.ec.europa.eu/european-breast-cancer-guidelines/Invitation-to-screening-and-decision-aid/subsequent-invitations/fixed-date (accessed on 2 March 2021).
[63] Eriksen, C. et al. (2021), What is the effectiveness of systematic population-level screening programmes for reducing the burden of cardiovascular diseases?, WHO Regional Office for Europe. WHO Health Evidence Network (HEN), Copenhagen.
[42] European Observatory on Health Systems and Policies and M. Petersen (2019), “Achieving better health and well-being via the Danish e-Health portal sundhed.dk”, Eurohealth, Vol. 25/2, pp. 20-23, https://apps.who.int/iris/handle/10665/332595 (accessed on 3 March 2021).
[21] Finnish Cancer Registry (2020), Cervical cancer screening - Syöpärekisteri, https://cancerregistry.fi/screening/cervical-cancer-screening/ (accessed on 1 March 2021).
[19] Fontham, E. et al. (2020), “Cervical cancer screening for individuals at average risk: 2020 guideline update from the American Cancer Society”, CA: A Cancer Journal for Clinicians, Vol. 70/5, pp. 321-346, https://doi.org/10.3322/caac.21628.
[27] Gioia, S. et al. (2018), “Brazil Needs Organized Breast Cancer Screening: Pilot Project in Rio De Janeiro”, Journal of Global Oncology, Vol. 4/Supplement 2, pp. 31s-31s, https://doi.org/10.1200/jgo.18.54900.
[3] GLOBOCAN (2020), Global Cancer Observatory, International Agency for Research on Cancer - World Health Organisation, https://gco.iarc.fr/ (accessed on 8 March 2021).
[61] Gmeinder, M., D. Morgan and M. Mueller (2017), “How much do OECD countries spend on prevention?”, OECD Health Working Papers, No. 101, OECD Publishing, Paris, https://dx.doi.org/10.1787/f19e803c-en.
[59] Habicht, T. et al. (2018), “Estonia: Health System Review”, Health Syst Transit, Vol. 20/1, pp. 1-189, https://pubmed.ncbi.nlm.nih.gov/30277217/ (accessed on 28 January 2021).
[28] IARC (2017), Cancer Screening in the European Union. Report on the implementation of the Council Recommendation on cancer screening, International Agency for Research on Cancer; European Commission.
[38] INCA (2020), Câncer de pulmão, Instituto Nacional de Câncer, https://www.inca.gov.br/tipos-de-cancer/cancer-de-pulmao (accessed on 2 March 2021).
[4] INCA (2020), Histórico das ações | INCA - Instituto Nacional de Câncer, https://www.inca.gov.br/controle-do-cancer-do-colo-do-utero/historico-das-acoes (accessed on 15 February 2021).
[15] INCA (2020), Prevenção do câncer do colo do útero, Instituto Nacional de Câncer, https://www.inca.gov.br/controle-do-cancer-do-colo-do-utero/acoes-de-controle/prevencao (accessed on 26 February 2021).
[33] INCA (2019), Câncer de intestino - versão para Profissionais de Saúde, Instituto Nacional de Câncer, https://www.inca.gov.br/tipos-de-cancer/cancer-de-intestino/profissional-de-saude (accessed on 2 March 2021).
[8] INCA (2013), Cancer in Brazil: Data from the Population-Based Registries, National Cancer Institute José Alencar Gomes da Silva, Rio de Janeiro, http://www.inca.gov.br (accessed on 2 March 2021).
[60] Kim, H. et al. (2012), “National screening program for transitional ages in Korea: A new screening for strengthening primary prevention and follow-up care”, Journal of Korean Medical Science, Vol. 27/SUPP, https://doi.org/10.3346/jkms.2012.27.S.S70.
[23] Levi, J. et al. (2019), “High-risk HPV testing in primary screening for cervical cancer in the public health system, São Paulo, Brazil”, Cancer Prevention Research, Vol. 12/8, pp. 539-546, https://doi.org/10.1158/1940-6207.CAPR-19-0076.
[53] Macinko, J., D. Leventhal and M. Lima-Costa (2018), “Primary Care and the Hypertension Care Continuum in Brazil”, Journal of Ambulatory Care Management, Vol. 41/1, pp. 34-46, https://doi.org/10.1097/JAC.0000000000000222.
[73] Maier, C., L. Aiken and R. Busse (2017), “Nurses in advanced roles in primary care: Policy levers for implementation”, OECD Health Working Papers, No. 98, OECD Publishing, Paris, https://dx.doi.org/10.1787/a8756593-en.
[35] Malila, N., C. Senore and P. Armaroli (2012), “European guidelines for quality assurance in colorectal cancer screening and diagnosis. First Edition Organisation”, Endoscopy, Vol. 44/SUPPL3, pp. SE31-SE48, https://doi.org/10.1055/s-0032-1309783.
[74] Martínez-González, N. et al. (2015), “The impact of physician-nurse task shifting in primary care on the course of disease: A systematic review”, Human Resources for Health, Vol. 13/1, p. 55, https://doi.org/10.1186/s12960-015-0049-8.
[12] Martínez-Mesa, J. et al. (2013), “Inequalities in Pap smear screening for cervical cancer in Brazil”, Preventive Medicine, Vol. 57/4, pp. 366-371, https://doi.org/10.1016/j.ypmed.2013.06.026.
[17] Mezei, A. et al. (2017), “Cost-effectiveness of cervical cancer screening methods in low- and middle-income countries: A systematic review”, International Journal of Cancer, Vol. 141/3, pp. 437-446, https://doi.org/10.1002/ijc.30695.
[54] Ministério da Saúde (2021), HIPERDIA. Sistema de Cadastramento e Acompanhamento de Hipertensos e Diabéticos- Notas Técnicas.
[58] Ministério da Saúde (2020), Indicadores de pagamento por desempenho do Programa Previne, Ministério da Saúde. Secretaria de Atenção Primária à Saúde, Departamento de Saúde da Família, https://sisab.saude.gov.br/resource/file/nota_tecnica_indicadores_de_desempenho_200210.pdf (accessed on 5 March 2021).
[55] Ministério da Saúde (2020), Manual - Como organizar o cuidado de pessoas com doenças crônicas na APS no contexto da pandemia, Ministério da Saúde. Secretaria de Atenção Primária à Saúde, Brasilia, http://aps.saude.gov.br (accessed on 5 March 2021).
[13] Ministério da Saúde (2013), Conselhos de saúde: a responsabilidade do controle social democrático do SUS, Ministerio da Saúde, Brasilia, http://www.conselho.saude.gov.br (accessed on 3 March 2021).
[52] Ministério da Saúde (2013), Estratégias para o cuidado da pessoa com doença crônica: diabetes mellitus, Ministério da Saúde. Secretaria de Atenção à Saúde, Departamento de Atenção Básica, http://www.dab.saude.gov.br (accessed on 4 March 2021).
[50] Ministério da Saúde (2013), Estratégias para o cuidado da pessoa com doença crônica: hipertensão arterial sistêmica, Ministério da Saúde. Secretaria de Atenção à Saúde, Departamento de Atenção Básica, http://aps.saude.gov.br/biblioteca/visualizar/MTIxNA== (accessed on 4 March 2021).
[49] Ministério da Saúde (2010), Rastreamento, Secretaria de Atenção à Saúde, Departamento de Atenção Básica, Ministério da Saúde, http://www.saude.gov.br/dab (accessed on 27 January 2021).
[6] Ministério da Saúde and INCA (2017), Diretrizes para a Detecção Precoce do Câncer de Mama no Brasil, Ministério da Saúde; Instituto Nacional de Câncer José Alencar Gomes da Silva, Rio de Janeiro, http://conitec.gov.br/images/Relatorios/2015/Relatorio_DDT_CancerMama_final.pdf. (accessed on 16 February 2021).
[45] Nascimento, B. et al. (2020), “Trends in prevalence, mortality, and morbidity associated with high systolic blood pressure in Brazil from 1990 to 2017: Estimates from the “global Burden of Disease 2017” (GBD 2017) study”, Population Health Metrics, Vol. 18/S1, p. 17, https://doi.org/10.1186/s12963-020-00218-z.
[62] NHS (2018), NHS RightCare » Diabetes pathway, https://www.england.nhs.uk/rightcare/products/pathways/diabetes-pathway/ (accessed on 28 January 2021).
[72] NHS England (2018), NHS RightCare » Diabetes pathway, https://www.england.nhs.uk/rightcare/products/pathways/diabetes-pathway/ (accessed on 7 March 2021).
[1] OCDE (2021), OECD Health Statistics 2021, https://www.oecd.org/health/health-data.htm (accessed on 15 January 2021).
[57] OCDE (2021), Strengthening the frontline: How primary health care helps health systems adapt during the COVID-19 pandemic, OECD Publishing, https://doi.org/10.1787/9a5ae6da-en.
[78] OCDE (2020), Realising the Potential of Primary Health Care, OECD Health Policy Studies, OECD Publishing, Paris, https://dx.doi.org/10.1787/a92adee4-en.
[2] OCDE (2019), OECD Reviews of Public Health: Chile: A Healthier Tomorrow, OECD Reviews of Public Health, OECD Publishing, Paris, https://dx.doi.org/10.1787/9789264309593-en.
[40] OCDE (2019), OECD Reviews of Public Health: Japan: A Healthier Tomorrow, OECD Reviews of Public Health, OECD Publishing, Paris, https://dx.doi.org/10.1787/9789264311602-en.
[79] OCDE (2019), Recommendation of the Council on Health Data Governance, OECD/LEGAL/0433, http://legalinstruments.oecd.org (accessed on 7 March 2021).
[81] OCDE (2016), Better Ways to Pay for Health Care, OECD Health Policy Studies, OECD Publishing, Paris, https://dx.doi.org/10.1787/9789264258211-en.
[34] OCDE (2013), Cancer Care: Assuring Quality to Improve Survival, OECD Health Policy Studies, OECD Publishing, Paris, https://dx.doi.org/10.1787/9789264181052-en.
[46] OCDE/The World Bank (2020), Health at a Glance: Latin America and the Caribbean 2020, OECD Publishing, Paris, https://dx.doi.org/10.1787/6089164f-en.
[75] Pousinho, S. et al. (2016), “Pharmacist Interventions in the Management of Type 2 Diabetes Mellitus: A Systematic Review of Randomized Controlled Trials”, Journal of Managed Care & Specialty Pharmacy, Vol. 22/5, pp. 493-515, https://doi.org/10.18553/jmcp.2016.22.5.493.
[47] Quarti Machado Rosa, M. et al. (2018), “Disease and Economic Burden of Hospitalizations Attributable to Diabetes Mellitus and Its Complications: A Nationwide Study in Brazil”, International Journal of Environmental Research and Public Health, Vol. 15/2, p. 294, https://doi.org/10.3390/ijerph15020294.
[24] Ribeiro, A. et al. (2018), hallenges to implementing a comprehensive cervical cancer screening program in Brazil: lessons from three cities to consider when moving on, IPVC, Sydney, https://www.arca.fiocruz.br/handle/icict/44737 (accessed on 1 March 2021).
[22] Ronco, G. (2020), Core elements of the new HPV-based cervical cancer screening programme in Italy, HPV World, https://www.hpvworld.com/articles/core-elements-of-the-new-hpv-based-cervical-cancer-screening-programme-in-italy/ (accessed on 1 March 2021).
[41] Sabatino, S. et al. (2012), Effectiveness of interventions to increase screening for breast, cervical, and colorectal cancers: Nine updated systematic reviews for the guide to community preventive services, Elsevier, https://doi.org/10.1016/j.amepre.2012.04.009.
[10] Silva, G. et al. (2017), “Early detection of breast cancer in Brazil: data from the National Health Survey, 2013”, Revista de Saúde Pública, Vol. 51/suppl 1, pp. 1S-8S, https://doi.org/10.1590/s1518-8787.2017051000191.
[14] TJCC (2021), Portal Movimento TJCC - Todos Juntos Contra o Câncer, https://tjcc.com.br/ (accessed on 4 March 2021).
[36] USPSTF (2021), FInal Recommendation Statement - Lung Cancer: Screening, United States Preventive Services Task Force, https://www.uspreventiveservicestaskforce.org/uspstf/recommendation/lung-cancer-screening (accessed on 2 March 2021).
[67] USPSTF (2016), Screening for High Blood Pressure in Adults: Recommendation Statement, http://www.uspreventiveservicestaskforce.org/. (accessed on 6 March 2021).
[70] USPSTF (2015), Abnormal Blood Glucose and Type 2 Diabetes Mellitus: Screening, United States Preventive Services Taskforce, https://www.uspreventiveservicestaskforce.org/uspstf/recommendation/screening-for-abnormal-blood-glucose-and-type-2-diabetes (accessed on 7 March 2021).
[32] Uy, C. et al. (2017), Text messaging interventions on cancer screening rates: A systematic review, JMIR Publications Inc., https://doi.org/10.2196/jmir.7893.
[18] von Karsa, L. et al. (2015), “Executive summary”, in Anttila, A. et al. (eds.), European guidelines for quality assurance in cervical cancer screening, Office for Official Publications of the European Union, Luxembourg, https://op.europa.eu/en/publication-detail/-/publication/a41a4c40-0626-4556-af5b-2619dd1d5ddc/language-en/format-PDF/source-search (accessed on 17 February 2021).
[76] Wang, Y., Q. Yeo and Y. Ko (2016), “Economic evaluations of pharmacist-managed services in people with diabetes mellitus: a systematic review”, Diabetic Medicine, Vol. 33/4, pp. 421-427, https://doi.org/10.1111/dme.12976.
[16] WHO (2021), “The Global Health Observatory: Explore a world of health data”, https://www.who.int/data/gho.
[43] WHO (2019), Primary health care on the road to universal health coverage: 2019 monitoring report.
[68] WHO (2018), HEARTS Technical package for cardiovascular disease management in primary health care: evidence-based treatment protocols, World Health Organisation, Geneva.
[26] WHO (2017), Guide to cancer early diagnosis, World Health Organisation, Geneva, https://www.who.int/cancer/publications/cancer_early_diagnosis/en/ (accessed on 2 March 2021).
[29] WHO (2014), WHO position paper on mammography screening, World Health Organisation, Geneva, https://apps.who.int/iris/handle/10665/137339 (accessed on 2 March 2021).
[66] Williams, B. et al. (2018), 2018 ESC/ESH Guidelines for themanagement of arterial hypertension, Oxford University Press, https://doi.org/10.1093/eurheartj/ehy339.
[71] Wong, W. (2017), “Exploring the Potential of Clinical Pathways for Diabetes”, Journal of Clinical Pathways, Vol. 2/Suppl 1, pp. S5-S6, https://www.journalofclinicalpathways.com/article/exploring-potential-clinical-pathways-diabetes (accessed on 7 March 2021).
[20] Yeh, P. et al. (2019), Self-sampling for human papillomavirus (HPV) testing: A systematic review and meta-Analysis, BMJ Publishing Group, https://doi.org/10.1136/bmjgh-2018-001351.
[56] Zhang, J. and A. et (2020), “Risk factors for disease severity, unimprovement, and mortality in COVID-19 patients in Wuhan, China”, Clinical Microbiology and Infection, Vol. 26/6, https://doi.org/10.1016/j.cmi.2020.04.012.
[44] Zhou, B. et al. (2017), “Worldwide trends in blood pressure from 1975 to 2015: a pooled analysis of 1479 population-based measurement studies with 19·1 million participants”, The Lancet, Vol. 389/10064, pp. 37-55, https://doi.org/10.1016/S0140-6736(16)31919-5.